Zadanie 11. Zapis równania reakcji chemicznej oraz wyjaśnienie dlaczego nie jest to reakcja redoks. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do uzyskania zawartości widocznej na 3. fotografii. Wyjaśnij, dlaczego opisanej przemiany nie można nazwać reakcją redoks. Równanie reakcji: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 12. Zapis wzorów sumarycznych związków chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:
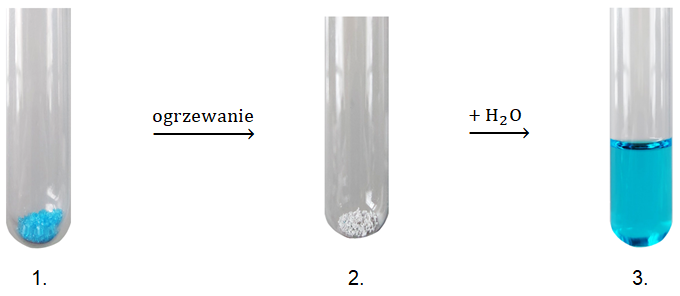
Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Napisz wzory sumaryczne ciał stałych znajdujących się w probówkach 1. oraz 2. 1.: 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 13. Zapis wzoru sumarycznego akwakompleksu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Roztwór w probówce 3. zawdzięcza swą barwę obecności jonów kompleksowych o liczbie koordynacyjnej 6, w których jonem centralnym są drobiny X2+, a cząsteczki wody – ligandami.
Napisz wzór sumaryczny opisanych akwakompleksów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 14.1. Zapis wzorów sumarycznych substancji. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Przeprowadzono dwuetapowe doświadczenie chemiczne.
Etap I.: do zawartości probówki 3. wprowadzono zasadę sodową.
Etap II.: uzyskaną mieszaninę poreakcyjną ogrzano w płomieniu palnika gazowego. Fotografie A oraz B przedstawiają zawartość naczyń po wykonaniu opisanych czynności.

Napisz wzory sumaryczne substancji chemicznych stanowiących widoczne na fotografiach A oraz B osady. A: B: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 15. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Do wodnego roztworu azotanu(V) srebra wprowadzono wodny roztwór pewnego związku chemicznego spośród
CuSO4, NH3, NaCl, KMnO4.
Uzyskano wówczas mieszaninę widoczną na zamieszczonej fotografii.

Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do powstania widocznej mieszaniny. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 16.1. Zapis równania reakcji tworzenia tlenku. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Poniższy schemat ilustruje ciąg przemian jakie można wykonać, w celu otrzymania odczynnika Tollensa – roztworu o odczynie zasadowym, zawierającego między innymi jony kompleksowe o liczbie koordynacyjnej 2, w których jonem centralnym jest kation srebra(I), a ligandami cząsteczki amoniaku.

Postępując według opisanego schematu, w pierwszym etapie doświadczenia powstaje tlenek X, w którym srebro ma taki sam stopień utlenienia jak w wyjściowym substracie reakcji.
Napisz w formie jonowej skróconej równanie reakcji chemicznej przebiegającej w 1. etapie, jeśli jako drugi z substratów zastosowano zasadę sodową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 16.2. Zapis równania reakcji z udziałem wody amoniakalnej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Poniższy schemat ilustruje ciąg przemian jakie można wykonać, w celu otrzymania odczynnika Tollensa – roztworu o odczynie zasadowym, zawierającego między innymi jony kompleksowe o liczbie koordynacyjnej 2, w których jonem centralnym jest kation srebra(I), a ligandami cząsteczki amoniaku.

Postępując według opisanego schematu, w pierwszym etapie doświadczenia powstaje tlenek X, w którym srebro ma taki sam stopień utlenienia jak w wyjściowym substracie reakcji.
Napisz jonowe równanie reakcji chemicznej przebiegającej w 2. etapie doświadczenia, w którym bierze udział woda amoniakalna. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 17. Zapis jonowo-elektronowy równania procesu redukcji. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Poniższy schemat ilustruje ciąg przemian jakie można wykonać, w celu otrzymania odczynnika Tollensa – roztworu o odczynie zasadowym, zawierającego między innymi jony kompleksowe o liczbie koordynacyjnej 2, w których jonem centralnym jest kation srebra(I), a ligandami cząsteczki amoniaku.

Wchodzący w skład odczynnika Tollensa jon kompleksowy w reakcji z odpowiednim reduktorem przekształcony zostaje w metaliczne srebro. Podczas takiej przemiany powstaje również bezbarwny gaz o charakterystycznym zapachu.
Napisz w formie jonowo-elektronowej równanie procesu redukcji opisanego jonu kompleksowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 18.1. Wybór zestawu odczynników. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Srebro pokrywające ścianki probówki można usunąć przeprowadzając doświadczenie według schematu:

Podkreśl ten zestaw, który stanowił odczynnik X zastosowany podczas eksperymentu. Fe2(SO4)3(aq) KMnO4(aq), H2SO4(aq) HNO3(stężony) © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 18.2. Zapis liczby elektronów oraz wartości głównej liczby kwantowej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Srebro pokrywające ścianki probówki można usunąć przeprowadzając doświadczenie według schematu:

Napisz liczbę wszystkich elektronów oraz wartość głównej liczby kwantowej opisującej zachowanie się sparowanych elektronów ostatniej powłoki w jonie prostym, w jaki przekształcony został osad ze ścianek probówki 1. Liczba elektronów w jonie: Wartość głównej liczby kwantowej: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 19. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:
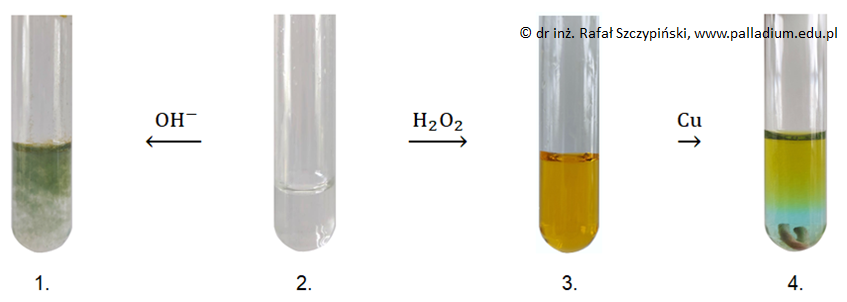
W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, w wyniku której powstała mieszanina w 2. probówce. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 20. Zapis podpowłokowej konfiguracji elektronowej odpowiednich kationów żelaza. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Stosując symbole podpowłok napisz konfigurację elektronową tych kationów żelaza, w których pierwiastek ten przyjmuje największy podczas opisanego doświadczenia stopień utlenienia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21.1. Zapis równań reakcji chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Po wprowadzeniu wodnego roztworu odpowiedniego odczynnika – nadtlenku wodoru lub w wodorotlenku sodu – do widocznych na fotografiach 1. oraz 3. zawartości probówek można uzyskać ten sam związek chemiczny, którego zawiesinę przedstawia zamieszczona poniżej fotografia.

Napisz równania reakcji chemicznych jakie przebiegły z udziałem zawartości probówek 1. oraz 3., w wyniku których powstał osad o którym mowa. Probówka 1.: Probówka 3.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21.2. Wskazanie nazwy zjawiska oraz nazwy metody rozdziału mieszanin. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Po wprowadzeniu wodnego roztworu odpowiedniego odczynnika – nadtlenku wodoru lub w wodorotlenku sodu – do widocznych na fotografiach 1. oraz 3. zawartości probówek można uzyskać ten sam związek chemiczny, którego zawiesinę przedstawia zamieszczona poniżej fotografia.

Po energicznym wstrząśnięciu zawartością tej probówki, do której wprowadzono roztwór NaOH naczynie fotografowano co kilka minut od momentu wykonania opisanej czynności:

Podaj nazwę zjawiska widocznego na czterech powyższych fotografiach, a następnie napisz nazwę metody rozdziału mieszanin, która wykorzystuje przedstawione zjawisko. Nazwa zjawiska: Nazwa metody: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone


