Wskazanie bieguna z jakim połączona jest elektroda, której masa wzrasta. Zadanie 18. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Elektroliza może być prowadzona na elektrodach, które nie biorą udziału w procesach elektrodowych (np. platyna, grafit), lub na elektrodach, które ulegają roztworzeniu w procesie anodowym. Efekt roztwarzania materiału anody wykorzystywany jest do oczyszczania metali w procesie elektrorafinacji.
Napisz, z jakim biegunem (dodatnim czy ujemnym) źródła prądu stałego połączona jest ta elektroda, której masa wzrasta podczas procesu elektrorafinacji.
Obliczanie stałej szybkości reakcji chemicznej. Zadanie 19a. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Reakcja A + 2B ⇄ C przebiega w temperaturze T według równania kinetycznego v = k·CA·CB2 . Początkowe stężenie substancji A było równe 2 mol·dm−3 , a substancji B było równe 3 mol·dm−3 . Szybkość początkowa tej reakcji była równa 5,4 mol·dm−3 · s−1 .
Oblicz stałą szybkości reakcji w temperaturze T, wiedząc, że dla reakcji przebiegającej według równania kinetycznego v = k·CA·CB2 stała szybkości k ma jednostkę: mol−2 · dm6 · s−1 .
Obliczanie szybkości reakcji w momencie przereagowania określonej ilości substratu. Zadanie 19b. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Reakcja A + 2B ⇄ C przebiega w temperaturze T według równania kinetycznego v = k·CA·CB2 . Początkowe stężenie substancji A było równe 2 mol·dm−3 , a substancji B było równe 3 mol·dm−3 . Szybkość początkowa tej reakcji była równa 5,4 mol·dm−3 · s−1 .
Korzystając z powyższych informacji, oblicz szybkość reakcji w momencie, gdy przereaguje 60% substancji A. Wynik podaj z dokładnością do czwartego miejsca po przecinku.
Zapis równań reakcji chemicznych na podstawie schematu ciągu przemian. Zadanie 20. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W laboratorium chemicznym alkany można otrzymać kilkoma sposobami, między innymi w reakcji halogenków alkilów z sodem przeprowadzonej w podwyższonej temperaturze. Przemiana ta prowadzi do wydłużenia łańcucha węglowego. Charakterystycznymi dla alkanów są przemiany z substancjami niepolarnymi. Taką reakcją jest podstawienie, np. atomu chloru w miejsce atomu wodoru, przebiegające pod wpływem światła lub ogrzania. Powstająca w tej przemianie monochloropochodna może – w podwyższonej temperaturze i w alkoholowym roztworze wodorotlenku potasu – ulegać reakcji eliminacji, tworząc związek nienasycony. Powstały alken przyłącza wodę w obecności kwasu siarkowego(VI), dając alkohol.
Opisane przemiany można przedstawić poniższym schematem.
![]()
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji oznaczonych na podanym schemacie numerami 1, 3. Skorzystaj z informacji i w równaniach reakcji (nad strzałkami) napisz warunki, w jakich zachodzą te przemiany. Równania reakcji: 1.: 3.:
Wskazanie mechanizmu reakcji oraz rolę jaką pełni opisany reagent. Zadanie 21ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W laboratorium chemicznym alkany można otrzymać kilkoma sposobami, między innymi w reakcji halogenków alkilów z sodem przeprowadzonej w podwyższonej temperaturze. Przemiana ta prowadzi do wydłużenia łańcucha węglowego. Charakterystycznymi dla alkanów są przemiany z substancjami niepolarnymi. Taką reakcją jest podstawienie, np. atomu chloru w miejsce atomu wodoru, przebiegające pod wpływem światła lub ogrzania. Powstająca w tej przemianie monochloropochodna może – w podwyższonej temperaturze i w alkoholowym roztworze wodorotlenku potasu – ulegać reakcji eliminacji, tworząc związek nienasycony. Powstały alken przyłącza wodę w obecności kwasu siarkowego(VI), dając alkohol.
Opisane przemiany można przedstawić poniższym schematem.
![]()
a) Określ, według jakiego mechanizmu: elektrofilowego, nukleofilowego czy rodnikowego przebiega reakcja oznaczona na schemacie numerem 2. b) Określ, czy nieorganiczny reagent reakcji oznaczonej na schemacie numerem 4 jest czynnikiem elektrofilowym, czy nukleofilowym.
Wskazanie liczby wiązań sigma oraz pi w cząsteczce. Zadanie 22. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Podaj liczbę wszystkich wiązań σ i wiązańπ w cząsteczce związku organicznego o wzorze: CH≡CCHO Liczba wiązań σ: Liczba wiązań π:
Rysowanie wzoru grupowego alkenu oraz kwasów będących produktami jego utleniania. Zadanie 23ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
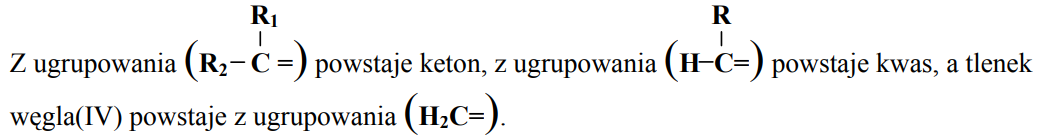
Pewien alken utleniany nadmiarem KMnO4 w środowisku kwasowym daje dwa różne kwasy karboksylowe, zaś w reakcji 1 mola tego alkenu z 1 molem wodoru powstaje n-heksan. a) Napisz wzór półstrukturalny (grupowy) tego alkenu. b) Podaj nazwy systematyczne dwóch kwasów karboksylowych powstałych podczas utleniania tego alkenu. 1. 2.
Zapis obserwacji pozwalających na odróżnienie związków chemicznych. Zadanie 24. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
W dwóch nieoznakowanych kolbach znajdowały się dwa alkeny (każdy w innym naczyniu). Wiadomo, że jednym związkiem był 2-metyloprop-1-en, a drugim but-2-en. W celu odróżnienia 2-metyloprop-1-enu od but-2-enu przeprowadzono doświadczenie, podczas którego do obu naczyń dodano zakwaszony, wodny roztwór KMnO4.
Korzystając z powyższych informacji, wymień po jednej obserwacji, która pozwoli na odróżnienie obu związków. Uzupełnij poniższą tabelę.
Rysowanie wzorów merów powstałych w wyniku polimeryzacji buta-1,3-dienu. Zadanie 25. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Buta-1,3-dien to związek o wzorze CH2=CH–CH=CH2. Jest on produktem wyjściowym do otrzymywania kauczuku syntetycznego. Polimeryzacja buta-1,3-dienu może przebiegać w położeniach 1, 4 lub 1, 2. W pierwszym przypadku powstają makrocząsteczki o nienasyconych łańcuchach liniowych, w drugim przypadku łańcuch główny polimeru nie zawiera podwójnych wiązań, natomiast występują one w łańcuchach bocznych
Napisz wzory merów obu polimerów, powstających w reakcji polimeryzacji buta-1,3-dienu, wiedząc, że mer to najmniejszy, powtarzający się fragment budowy łańcucha polimeru.
Przypisywanie stopni utlenienia atomom węgla. Zadanie 26. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Określ stopnie utlenienia atomów węgla (podkreślone symbole) w cząsteczkach, których wzory podano w tabeli.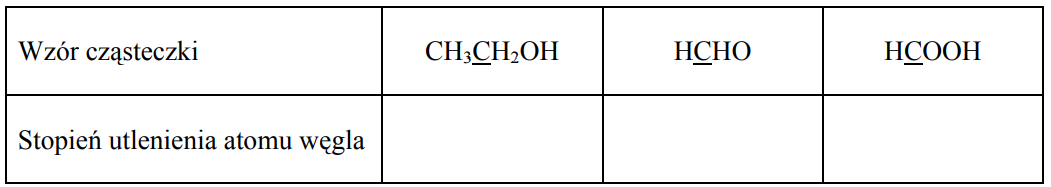
Wskazanie nazw grup związków chemicznych oraz zapis równania hydrolizy związku chemicznego. Zadanie 27ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Związek organiczny X o wzorze sumarycznym C7H6O2 ulega reakcji hydrolizy. Produktami tej reakcji w środowisku kwasowym są związki Y i Z. Substancja Y, jako jedyny przedstawiciel swojego szeregu homologicznego, ma właściwości redukujące. Związek Z w reakcji z chlorkiem żelaza(III) daje związek kompleksowy o fioletowej barwie.
a) Podaj nazwy grup związków, do których należą substancje organiczne X, Y i Z. X: Y: Z: b) Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji hydrolizy kwasowej związku organicznego X.
Rysowanie wzorów dwóch izomerycznych związków organicznych. Zadanie 28. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Dwa związki organiczne A i B są względem siebie izomerami. W wyniku bromowania zarówno związku A jak i związku B powstaje kwas 2,3-dibromobutanowy.
Narysuj wzory strukturalne związków A i B, tak aby jednoznacznie wskazywały na występujący w nich rodzaj izomerii.
Rysowanie wzoru chiralnego triglicerydu. Zadanie 29. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Cząsteczki glicerolu, kwasu palmitynowego C15H31COOH i kwasu stearynowego C17H35COOH są achiralne, ale cząsteczki związku powstającego w reakcji glicerolu z tymi kwasami mogą być chiralne.
Narysuj wzór triglicerydu, zawierającego reszty kwasów palmitynowego i stearynowego, którego cząsteczki są chiralne.
Rysowanie projekcji Fischera L-arabinozy. Zadanie 30. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
L-arabinoza jest aldopentozą, w cząsteczce której grupa -OH przy atomie węgla połączonym z grupą aldehydową znajduje się po przeciwnej stronie niż grupy -OH przy pozostałych asymetrycznych atomach węgla.
Na podstawie podanej informacji uzupełnij rysunek, tak aby był on wzorem L-arabinozy w projekcji Fischera.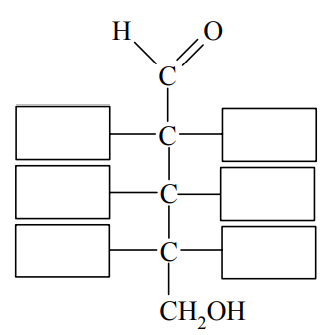
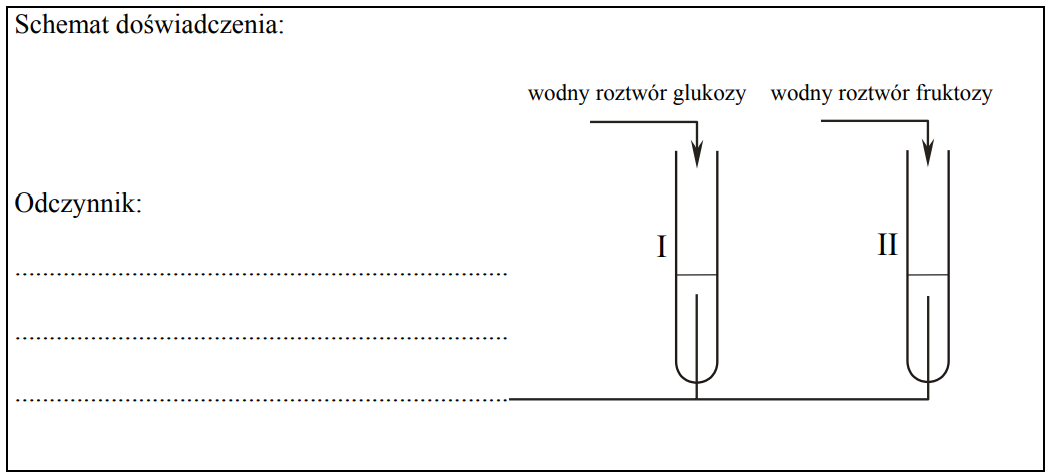
Projektowanie doświadczenia, które pozwoli na rozróżnienie wodnych roztworów glukozy i fruktozy. Zadanie 31ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Zaprojektuj doświadczenie, które pozwoli na rozróżnienie wodnych roztworów dwóch cukrów: glukozy i fruktozy.
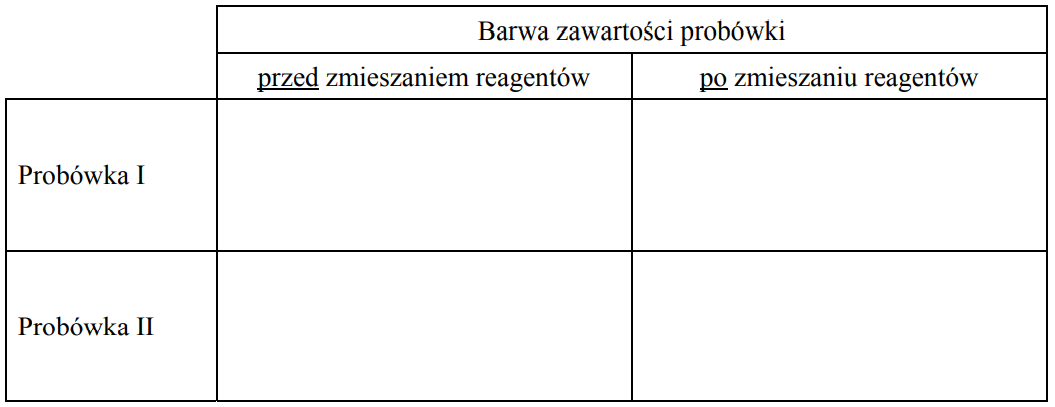
a) Uzupełnij schemat doświadczenia, wpisując nazwę użytego odczynnika wybranego z podanej poniżej listy: – świeżo wytrącony wodorotlenek miedzi(II) b) Napisz, jakie obserwacje potwierdzą obecność glukozy w probówce I i fruktozy w probówce II po wprowadzeniu tych substancji do wybranego odczynnika (wypełnij poniższą tabelę).
- woda bromowa z dodatkiem wodnego roztworu wodorowęglanu sodu
- wodny roztwór azotanu(V) srebra z dodatkiem wodnego roztworu amoniaku.