Obliczanie liczby moli kwasu octowego w stanie równowagi. Zadanie 32. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
![]()
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
W naczyniu o objętości V zmieszano w temperaturze 25 °C 1 mol kwasu etanowego i 1 mol etanolu. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI).
Oblicz, ile moli kwasu etanowego pozostało w mieszaninie po ustaleniu się stanu równowagi.
Wskazanie czynności skutkujących zwiększeniem wydajności reakcji estryfikacji. Zadanie 33. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
![]()
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
Podkreśl wszystkie wymienione poniżej działania, które spowodują zwiększenie wydajności opisanej reakcji estryfikacji w temperaturze 25 °C. dodanie etanolu dodanie wody dodanie katalizatora dodanie obojętnej wobec reagentów substancji higroskopijnej.
Zapis wzorów grupowych pochodnych alkoholu monohydroksylowego. Zadanie 34. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Poniżej przedstawiono schemat przemian, jakim ulegają pochodne węglowodorów. Symbolami R i R1 oznaczono grupy alkilowe.
![]()
Wypełnij tabelę, wpisując ogólne wzory pochodnych związku RCH2OH, które na schemacie oznaczono numerami I–IV.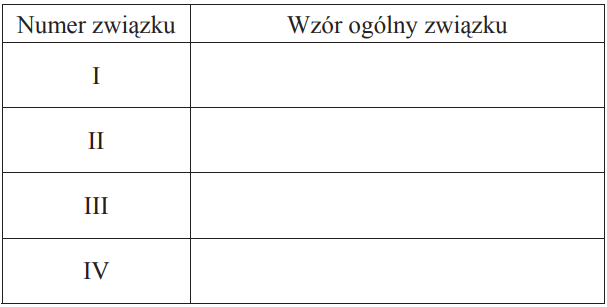
Wskazanie liczby niecyklicznych produktów kondensacji alaniny z kwasem asparaginowym. Zadanie 35. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.
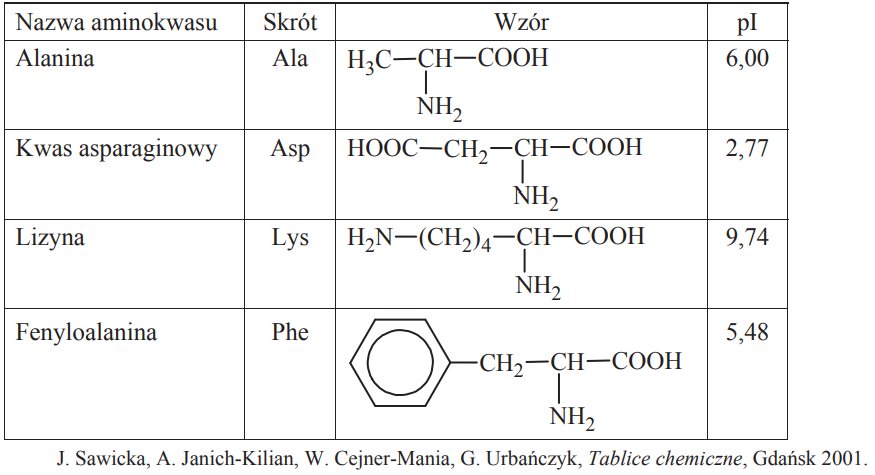
Określ liczbę wszystkich możliwych organicznych niecyklicznych produktów kondensacji jednej cząsteczki alaniny z jedną cząsteczką kwasu asparaginowego.
Rysowanie formy fenyloalaniny dominującej w roztworze o pH = 5,48. Zadanie 36. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.

Napisz wzór tej formy fenyloalaniny, której stężenie jest największe w roztworze o pH równym 5,48.
Projektowanie doświadczenia polegającego na odróżnieniu alaniny od fenyloalaniny. Zadanie 37ab. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.

Zaplanuj doświadczenie, którego przebieg pozwoli na odróżnienie alaniny od fenyloalaniny. a) Uzupełnij poniższy schemat doświadczenia, wpisując nazwę odczynnika, po którego dodaniu do obu probówek i ogrzaniu ich zawartości możliwe będzie zaobserwowanie różnic w przebiegu doświadczenia z udziałem alaniny i fenyloalaniny. Odczynnik wybierz spośród następujących: − wodny roztwór chlorku żelaza(III) − świeżo strącony wodorotlenek miedzi(II) − wodny roztwór wodorotlenku sodu z fenoloftaleiną − rozcieńczony kwas solny z oranżem metylowym − mieszanina stężonych kwasów: azotowego(V) i siarkowego(VI) Wybrany odczynnik: b) Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia, pozwalające na odróżnienie alaniny od fenyloalaniny. Probówka I: Probówka II: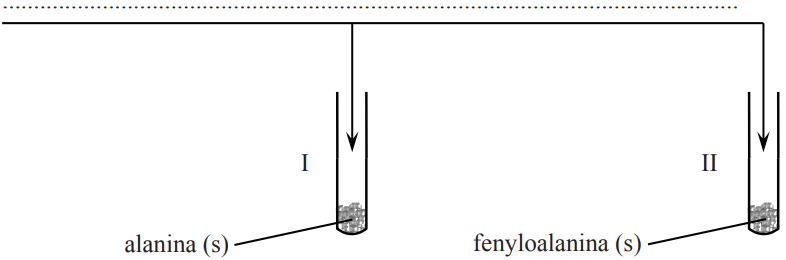
Wskazanie przyczyny różnicy wartości punktu izoelektrycznego kwasu asparaginowego i lizyny. Zadanie 38. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.

Wskaż przyczynę różnicy wartości punktu izoelektrycznego kwasu asparaginowego i lizyny.
Ocena poprawności zdań dotyczących sacharozy oraz maltozy. Zadanie 39. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Poniżej przedstawiono wzory (w projekcji Hawortha) dwóch disacharydów: maltozy i sacharozy.
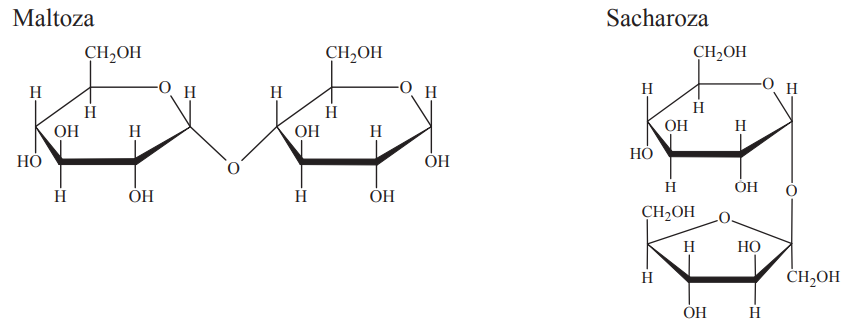
W oddzielnych probówkach przygotowano wodne roztwory maltozy oraz sacharozy i dodano do nich świeżo strącony wodorotlenek miedzi(II). Następnie zawartość obu probówek zalkalizowano i ogrzano. W warunkach doświadczenia w probówce zawierającej roztwór maltozy zaobserwowano powstanie ceglastego osadu, natomiast w probówce z roztworem sacharozy wytrącił się czarny osad.
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe. 1. W reakcji z maltozą wodorotlenek miedzi(II) uległ redukcji do Cu2O, o czym świadczy powstanie ceglastego osadu. 2. Czarny osad powstający w probówce z roztworem sacharozy to CuO, który jest produktem rozkładu wodorotlenku miedzi(II). 3. Sacharoza nie wykazała właściwości redukujących, ponieważ w jej cząsteczkach wiązanie glikozydowe łączy pierwszy atom węgla reszty glukozy z drugim atomem węgla reszty fruktozy.
Rozszyfrowanie pierwiastka chemicznego na podstawie opisu jego elektronów. Zadanie 1a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu w stanie podstawowym pierwiastka X wynika, że w tym atomie:
– elektrony rozmieszczone są na trzech powłokach elektronowych
– w powłoce walencyjnej liczba elektronów sparowanych jest równa liczbie elektronów niesparowanych.
Uzupełnij poniższą tabelę, wpisując symbol chemiczny pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.
Zapis podpowłokowej elektronowej konfiguracji walencyjnej rozszyfrowanego pierwiastka. Zadanie 1b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu w stanie podstawowym pierwiastka X wynika, że w tym atomie:
– elektrony rozmieszczone są na trzech powłokach elektronowych
– w powłoce walencyjnej liczba elektronów sparowanych jest równa liczbie elektronów niesparowanych.
Napisz fragment konfiguracji elektronowej atomu pierwiastka X opisujący rozmieszczenie w podpowłokach elektronów walencyjnych.
Zapis liczb kwantowych dla niesparowanego elektronu rozszyfrowanego pierwiastka chemicznego. Zadanie 1c. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu w stanie podstawowym pierwiastka X wynika, że w tym atomie:
– elektrony rozmieszczone są na trzech powłokach elektronowych
– w powłoce walencyjnej liczba elektronów sparowanych jest równa liczbie elektronów niesparowanych.
Dla jednego ze sparowanych elektronów walencyjnych podaj wartości dwóch charakteryzujących go liczb kwantowych: głównej i pobocznej. Obie wartości wpisz do tabeli.
Wybór poprawnych wyrazów dotyczących tlenowców oraz fluorowców. Zadanie 2. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Na podstawie budowy atomów pierwiastków należących do 16. i 17. grupy i trzeciego okresu układu okresowego uzupełnij poniższe zdania. Wybierz i podkreśl jedno z określeń podanych w nawiasie, tak aby powstały zdania prawdziwe. Jądro atomu fluorowca ma ładunek ( mniejszy / większy ) niż jądro atomu tlenowca. Atom fluorowca ma ( mniejszy / większy ) promień atomowy niż atom tlenowca. Tlenowiec jest ( bardziej / mniej ) aktywny chemicznie od fluorowca.
Zapis równania reakcji jądrowej. Zadanie 3. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Na cześć wybitnego polskiego astronoma Mikołaja Kopernika pierwiastek o liczbie atomowej 112 otrzymał nazwę copernicium i symbol Cn. Reakcja prowadząca do otrzymania tego pierwiastka zachodzi pomiędzy jądrami 208Pb i 70Zn. Towarzyszy jej emisja pewnej cząstki wchodzącej w skład atomu.
Napisz równanie opisanej reakcji jądrowej. Uzupełnij wszystkie pola w podanym schemacie.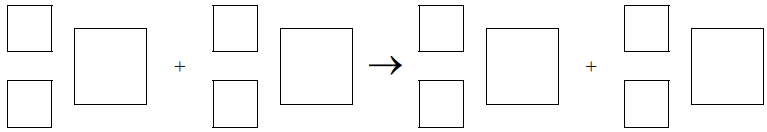
Obliczanie czasu po jakim pozostanie określona masa radionuklidu. Zadanie 4a. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
Jednym z promieniotwórczych izotopów strontu jest 90Sr. Jego okres półtrwania wynosi około 28 lat. Izotop ten jest bardzo niebezpieczny dla człowieka, ponieważ ze względu na swoje właściwości chemiczne łatwo wbudowuje się w tkankę kostną w miejsce nieradioaktywnego izotopu innego pierwiastka.
Oblicz, po jakim czasie z próbki 90Sr o masie 51,2 mg pozostanie 0,4 mg tego izotopu.

