Zadanie 19. Arkusz Palladium kwiecień 2017 (1 punkt)
Pewna blaszka wykonana ze stali została pokryta cienką warstwą srebra. Po pewnym czasie przedmiot uległ zarysowaniu, a stal w miejscu opisanego uszkodzenia skorodowała.
Wyjaśnij, dlaczego pomimo warstwy ochronnej, w miejscu zarysowania stal skorodowała. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 29. Arkusz Palladium kwiecień 2017 (1 punkt)
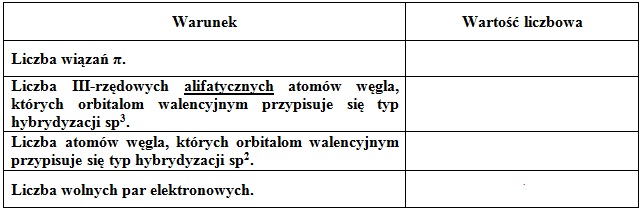
Przykładem niesteroidowego, przeciwzapalnego leku jest związek chemiczny o nazwie ibuprofen, a jego cząsteczkę można przedstawić wzorem w postaci:
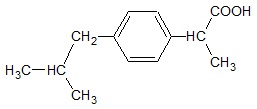
Przeanalizuj budowę cząsteczki ibuprofenu, a następnie uzupełnij poniższą tabelę wartościami liczbowymi, jakie dotyczą warunków opisanych poszczególnymi zdaniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone