Wybór właściwego piktogramu chemicznego oraz wskazanie rodzaju elementów ubioru ochronnego
Przeprowadzono doświadczenie chemiczne, którego celem było odróżnienie wodnego roztworu glukozy od propanonu. W tym celu do świeżo przygotowanych alkalicznych zawiesin wodorotlenku miedzi(II) wprowadzono badane odczynniki. Zawartość naczyń wstrząśnięto, a następnie ogrzano uzyskując układy widoczne na zamieszczonej fotografii:

Wykorzystany w celu uzyskania alkalicznej zawiesiny roztwór wodorotlenku sodu jest substancją niebezpieczną, którą opisuje jeden z niżej zamieszczonych piktogramów:

Wybierz numer właściwego piktogramu, a następnie wymień dwa inne niż fartuch elementy ubioru ochronnego, jakie należy zastosować podczas pracy z tym preparatem. Wybrany piktogram: Elementy ubioru ochronnego: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symboli pierwiastków chemicznych oraz ich położenia w układzie okresowym. Zadanie 1.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
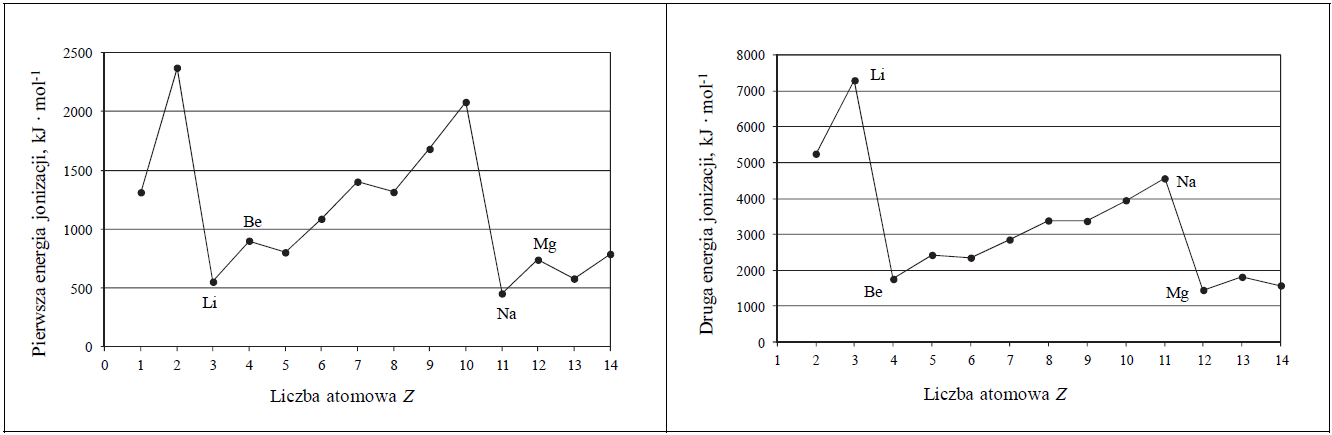
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
• atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
• atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Uzupełnienie zapisu konfiguracji klatkowej rozszyfrowanego pierwiastka. Zadanie 1.2. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
• atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
• atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
Wybierz pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
Zapis wzoru sumarycznego wodorku oraz tlenku rozszyfrowanych pierwiastków. Zadanie 1.3. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
• atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
• atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia. Wzór sumaryczny wodorku pierwiastka X: Wzór sumaryczny tlenku pierwiastka Z:
Rysowanie wzoru elektronowego kreskowego chlorku arsenu(III) określenie jego budowy krystalicznej. Zadanie 3.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Chlorek arsenu(III) – AsCl3 – jest w temperaturze pokojowej cieczą. W stanie ciekłym chlorek arsenu(III) nie przewodzi prądu elektrycznego. W reakcji z wodą tworzy kwas arsenowy(III) o wzorze H3AsO3 oraz chlorowodór.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Czy chlorek arsenu(III) ma budowę kowalencyjną, czy – jonową? Narysuj wzór elektronowy chlorku arsenu(III). Uwzględnij wolne pary elektronowe. Chlorek arsenu(III) ma budowę: Wzór:
Zapis równania reakcji chlorku arsenu(III) z wodą. Zadanie 3.2. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Chlorek arsenu(III) – AsCl3 – jest w temperaturze pokojowej cieczą. W stanie ciekłym chlorek arsenu(III) nie przewodzi prądu elektrycznego. W reakcji z wodą tworzy kwas arsenowy(III) o wzorze H3AsO3 oraz chlorowodór.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie cząsteczkowej równanie reakcji chlorku arsenu(III) z wodą.
Wybór najmocniejszego kwasu i najsłabszej zasady Brønsteda. Zadanie 4. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Zależność między mocą kwasu Brønsteda a mocą zasady sprzężonej z tym kwasem opisuje równanie:
Ka · Kb = Kw
gdzie: Ka – stała dysocjacji kwasu, Kb – stała dysocjacji sprzężonej zasady, a Kw – iloczyn jonowy wody.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Dane są kwasy karboksylowe o wzorach:
I CH3COOH II CH3CH2COOH III C6H5COOH
Uzupełnij poniższe zdania. Wpisz w wyznaczone miejsca odpowiednie wzory i podkreśl właściwe określenie spośród wymienionych w nawiasie. Spośród związków oznaczonych numerami I, II i III najmocniejszym kwasem jest . Spośród zasad sprzężonych z kwasami I, II i III najsłabszą zasadą jest . W sprzężonej parze kwas–zasada im słabszy jest kwas, tym (mocniejsza / słabsza) jest sprzężona z nim zasada.
Wybór poprawnych określeń dotyczących równowagowej reakcji syntezy amoniaku. Zadanie 5. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
W poniższej tabeli zestawiono wartości stałej równowagi reakcji syntezy amoniaku w różnych temperaturach.
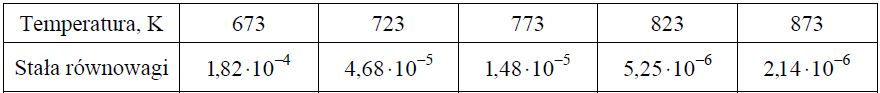
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Przeanalizuj dane dotyczące syntezy amoniaku. Następnie uzupełnij zdania wyrażeniami spośród podanych poniżej. zmaleje wzrośnie się nie zmieni Jeżeli w układzie będącym w stanie równowagi nastąpi wzrost temperatury w warunkach izobarycznych (p = const), to wydajność reakcji syntezy amoniaku , natomiast przy wzroście ciśnienia w warunkach izotermicznych (T = const) wydajność tego procesu . Jeżeli zmaleje temperatura w układzie, to szybkość reakcji syntezy amoniaku .
Obliczanie procentu objętościowego amoniaku w mieszaninie poreakcyjnej. Zadanie 6. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
W mieszaninie wodoru i azotu użytej do syntezy amoniaku zawartość wodoru wyrażona w procentach objętościowych jest równa 75%. Wydajność reakcji syntezy amoniaku przeprowadzonej w temperaturze T i pod ciśnieniem p jest równa 93%.
Oblicz wyrażoną w procentach objętościowych zawartość amoniaku w mieszaninie poreakcyjnej.
Rysowanie wykresu zależności stężenia produktu od czasu trwania reakcji chemicznej. Zadanie 7. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Do reaktora wprowadzono próbkę gazowego związku A i zainicjowano reakcję:
A (g) ⇄ 2B (g)
Przemianę prowadzono w stałej objętości. Mierzono stężenie związku A w czasie trwania reakcji. Tę zależność przedstawiono na poniższym wykresie.
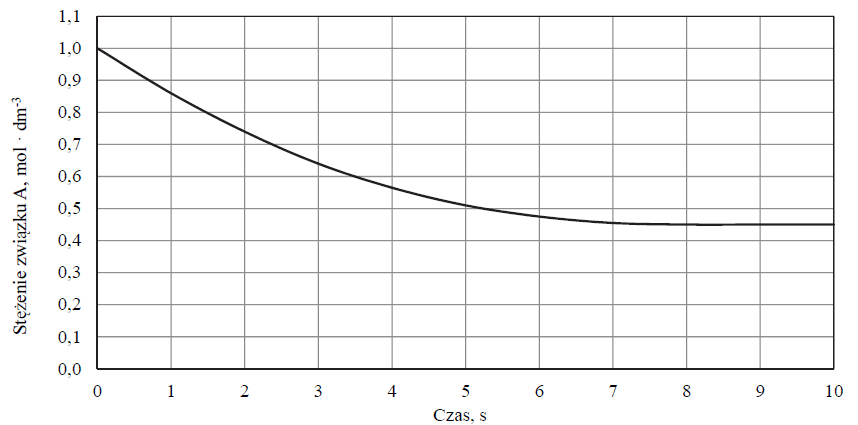
Na podstawie powyższych informacji narysuj wykres przedstawiający zależność stężenia związku B od czasu trwania reakcji.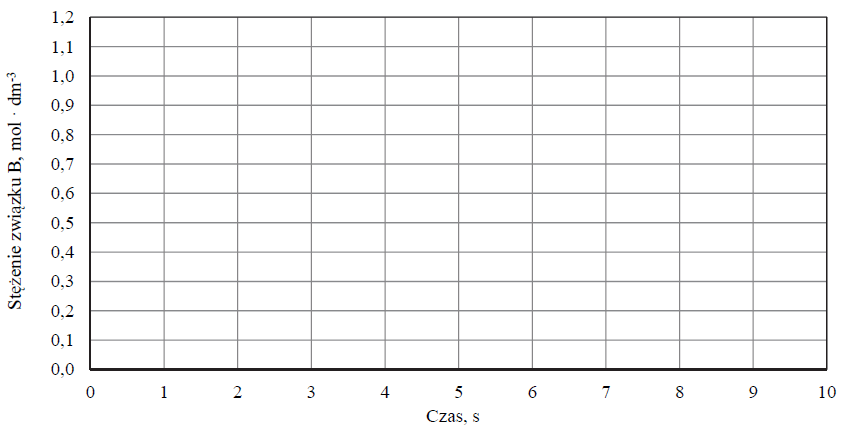
Obliczanie masy próbki węglanu wapnia poddanej prażeniu. Zadanie 8. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Próbkę czystego węglanu wapnia o masie m prażono w otwartym naczyniu. Przebiegła wtedy reakcja zilustrowana równaniem:
CaCO3 → CaO + CO2
Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowała się mieszanina substancji stałych o masie 18,0 gramów. Ustalono, że w tej mieszaninie zawartość węglanu wapnia wyrażona w procentach masowych jest równa 57,5%.
Oblicz masę m próbki węglanu wapnia poddanej prażeniu.