Obliczanie objętości gazu wydzielonego w wyniku elektrolizy wodorków sodu oraz potasu (elektroliza)
Stopy metali sporządza się w celu uzyskania określonych parametrów fizykochemicznych danego materiału. Niektóre z nich mogą mieć temperatury topnienia niższe, niż każdy ze składników z osobna. Przykładem może być mieszanina sodu z potasem, której temperatura topnienia wynosi –12,5 oC. W układzie takim znajduje się wówczas dwukrotnie więcej atomów tego pierwiastka chemicznego, który ma większą liczbę powłok elektronowych.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W celu przygotowania 75,75 g opisanego stopu potasu z sodem, w dwóch różnych elektrolizerach przeprowadzono elektrolizę stopionych wodorków wymienionych metali.
Oblicz, jaką objętość w przeliczeniu na warunki normalne zajął wydzielony podczas elektrolizy obu wodorków gaz? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy wapnia wydzielonego podczas elektrolizy w układzie szeregowego połączenia elektrolizerów (elektroliza)
Stopy metali sporządza się w celu uzyskania określonych parametrów fizykochemicznych danego materiału. Niektóre z nich mogą mieć temperatury topnienia niższe, niż każdy ze składników z osobna. Przykładem może być mieszanina sodu z potasem, której temperatura topnienia wynosi –12,5 oC. W układzie takim znajduje się wówczas dwukrotnie więcej atomów tego pierwiastka chemicznego, który ma większą liczbę powłok elektronowych.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W celu przygotowania 75,75 g opisanego stopu potasu z sodem, w dwóch różnych elektrolizerach przeprowadzono elektrolizę stopionych wodorków wymienionych metali.
Podczas połączenia szeregowego elektrolizerów, przez każdy nich przepływa ładunek elektryczny o takiej samej wartości. Elektrolizer, w którym wydzielono sód połączony był szeregowo z innym elektrolizerem – zawierającym stopiony chlorek wapnia.
Oblicz, masę wapnia, jaka mogła zostać maksymalnie wydzielona w wyniku elektrolizy tej soli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby jonów srebra zredukowanych podczas elektrolizy w układzie równoległego połączenia elektrolizerów (elektroliza)
Zgodnie z pierwszym prawem Kirchhoffa sumaryczne natężenie prądu elektrycznego przepływającego przez urządzenia połączone równolegle w obwodzie elektrycznym, równe jest natężeniu prądu elektrycznego jaki wypłynął z jego źródła.
Przeprowadzono elektrolizę wodnych roztworów – siarczanu(VI) miedzi(II) oraz azotanu(V) srebra z udziałem elektrod platynowych. W pierwszym z wymienionych elektrolizerów, które połączone były równolegle wydzielona miedź miała masę 41,6 g.
Wiedząc, że całkowity ładunek elektryczny jaki przepłynął przez obwód miał wartość 2,1 F, oszacuj liczbę jonów srebra jakie uległy redukcji w drugim elektrolizerze. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalenie symbolu pierwiastka chemicznego na podstawie elektrolizy roztworów jego soli w układzie równoległego połączenia elektrolizerów (elektroliza)
Zgodnie z pierwszym prawem Kirchhoffa sumaryczne natężenie prądu elektrycznego przepływającego przez urządzenia połączone równolegle w obwodzie elektrycznym, równe jest natężeniu prądu elektrycznego jaki wypłynął z jego źródła.
W celu elektrolitycznego wydzielenia jednego mola pewnego pierwiastka metalicznego X należy dostarczyć ładunku elektrycznego o wartości 2 F. Podczas zajęć szkolnych połączono równolegle dwa elektrolizery. W pierwszym z nich znajdował się wodny roztwór bromku metalu X, a w drugim – jodek tego pierwiastka. Stwierdzono, że masa substancji wydzielonej na katodzie każdego z elektrolizerów była taka sama i wynosiła 2,6 g.
Ustal symbol pierwiastka X, jeśli wiadomo, że elektrolizę prowadzono przez dwie godziny lekcyjne prądem o natężeniu 2,85 A. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących aminokwasu oraz hydroksyaldehydu (izomeria optyczna)
Rysunek poniżej przedstawia wzory chemiczne cząsteczek pewnych związków chemicznych.
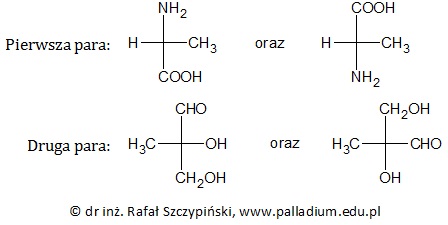
Oceń poprawność poniższych zdań dotyczących związków chemicznych, których wzory przedstawiono w informacji wprowadzającej. Wpisz literę „P” (prawda) lub literę „F” (fałsz). 1. Każda z narysowanych cząsteczek wykazuje czynność optyczną. 2. Pierwsza para stanowi związki chemiczne, których wodne roztwory mają odczyn obojętny. 3. Pierwszą parę związków chemicznych od drugiej pary można odróżnić stosując jako odczynnik wodny roztwór wodorowęglanu sodu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór pary wzorów stanowiących tę samą cząsteczkę, ale inaczej narysowaną (izomeria optyczna)
Rysunek poniżej przedstawia wzory chemiczne cząsteczek pewnych związków chemicznych.

Spośród narysowanych wzorów związków organicznych wybierz parę przedstawiającą tę samą cząsteczkę, ale inaczej narysowaną, a następnie uwzględniając właściwy szereg konfiguracyjny (L lub D) podaj jej nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór określonego związku chemicznego będącego produktem procesu wypieku ciasta z uzasadnieniem wyboru
W skład proszku do pieczenia wchodzą zwykle dwa związki chemiczne – wodorowęglan sodu (soda oczyszczona) lub wodorowęglan amonu (tzw. amoniak do pieczenia). W temperaturze wypieku równej 180 ⁰C oba rozkładają się z wydzieleniem gazowych produktów, przy czym podczas rozkładu sody oczyszczonej powstaje dodatkowo związek chemiczny o stałym stanie skupienia, zawierający 43,4% sodu.
Do wypieku 600 g ciasta (1000 hPa) wykorzystano 15 g wodorowęglanu amonu. Gazowe produkty reakcji jego rozkładu spowodowały spulchnienie ciasta.
Który spośród produktów reakcji rozkładu amoniaku do pieczenia pierwszy opuści piekarnik, a który ostatni? Uwzględnij wyłącznie te związki chemiczne, które w warunkach normalnych są gazami. Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem proszku do pieczenia
W skład proszku do pieczenia wchodzą zwykle dwa związki chemiczne – wodorowęglan sodu (soda oczyszczona) lub wodorowęglan amonu (tzw. amoniak do pieczenia). W temperaturze wypieku równej 180 oC oba rozkładają się z wydzieleniem gazowych produktów, przy czym podczas rozkładu sody oczyszczonej powstaje dodatkowo związek chemiczny o stałym stanie skupienia, zawierający 43,4% sodu.
Do wypieku 600 g ciasta (1000 hPa) wykorzystano 15 g wodorowęglanu amonu. Gazowe produkty reakcji jego rozkładu spowodowały spulchnienie ciasta.
Napisz równania reakcji chemicznych w wyniku przebiegu których powstały związki chemiczne, które spowodowały spulchnienie ciasta, w zależności od zastosowanego proszku do pieczenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Równanie reakcji chemicznej soli kwasu węglowego z kwasem azotowym(V)
Na minerał zawierający po 0,1 mola każdego z węglanów: baru, srebra oraz wapnia podziałano stechiometryczną ilością stężonego roztworu kwasu azotowego(V). Zawartość naczynia ogrzewano, a po ochłodzeniu uzupełniono wodą do wyjściowej objętości roztworu.
Napisz w formie jonowej skróconej równanie przebiegającej reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone