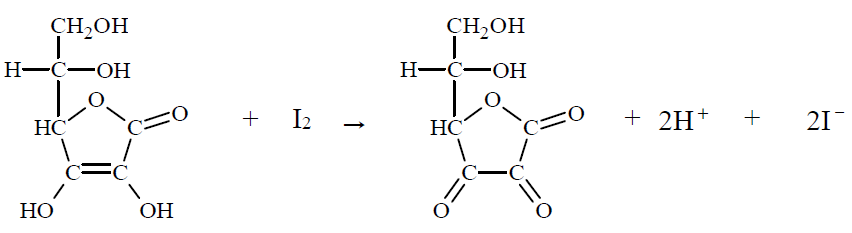
Opis barwnych zmian zarejestrowanych podczas doświadczenia z udziałem kwasu solnego i roztworu manganianu(VII) potasu. Zadanie 36.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W laboratorium pod wyciągiem przeprowadzono reakcję manganianu(VII) potasu z nadmiarem kwasu solnego. Do wykrycia gazowego produktu zastosowano papierek jodoskrobiowy zwilżony wodą. Przebieg doświadczenia zilustrowano na poniższym schemacie.
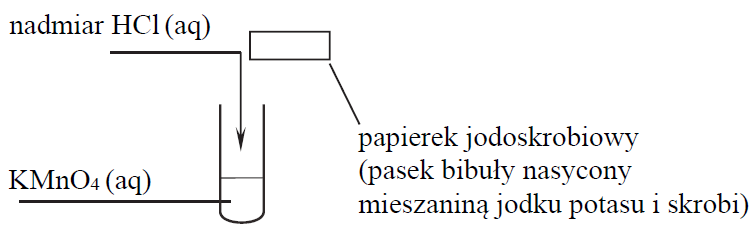
Opisz zmiany możliwe do zaobserwowania podczas przebiegu doświadczenia. Uzupełnij poniższą tabelę.
Wyjaśnienie przyczyny zmiany barwy papierka jodoskrobiowego podczas doświadczenia. Zadanie 36.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W laboratorium pod wyciągiem przeprowadzono reakcję manganianu(VII) potasu z nadmiarem kwasu solnego. Do wykrycia gazowego produktu zastosowano papierek jodoskrobiowy zwilżony wodą. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Wyjaśnij przyczynę zmiany barwy papierka jodoskrobiowego.
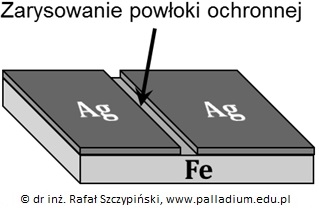
Uzupełnienie schematu doświadczenia odpowiednim odczynnikiem potwierdzającym obecność określonych substancji. Zadanie 37.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Wykonano doświadczenie, w którym do probówki I wprowadzono wodny roztwór mocznika CO(NH2)2, a do probówki II – wodny roztwór węglanu amonu (NH4)2CO3. Następnie do obu probówek dodano ten sam odczynnik, który umożliwił potwierdzenie zawartości obu probówek. Wybrano jeden odczynnik spośród:
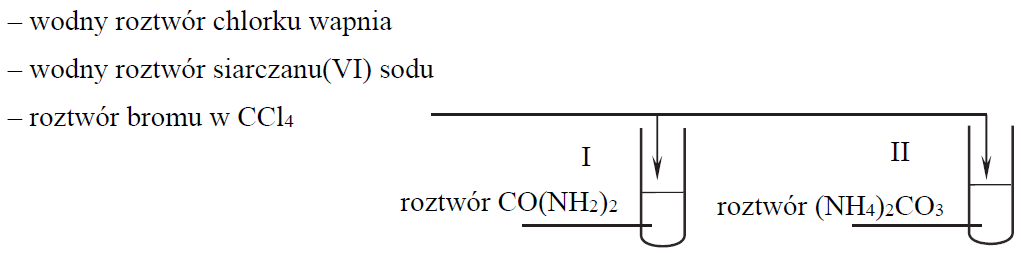
Uzupełnij schemat doświadczenia. Podkreśl nazwę odczynnika, który – po dodaniu do probówek z roztworami opisanych związków i wymieszaniu ich zawartości – umożliwi zaobserwowanie różnic w przebiegu doświadczenia z udziałem mocznika i węglanu amonu.
Zapis obserwacji podczas doświadczenia z udziałem roztworu mocznika oraz roztworu węglanu amonu. Zadanie 37.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Wykonano doświadczenie, w którym do probówki I wprowadzono wodny roztwór mocznika CO(NH2)2, a do probówki II – wodny roztwór węglanu amonu (NH4)2CO3. Następnie do obu probówek dodano ten sam odczynnik, który umożliwił potwierdzenie zawartości obu probówek. Wybrano jeden odczynnik spośród:

Napisz, jakie obserwacje potwierdzą, że w probówce I znajduje się wodny roztwór mocznika, a w probówce II – wodny roztwór węglanu amonu. Probówka I: Probówka II:
Rysowanie wzoru półstrukturalnego kwasu karboksylowego oraz nazwy jego bromopochodnej. Zadanie 38. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Aminokwasy białkowe są α-aminokwasami, co znaczy, że w ich cząsteczkach jedna para grup funkcyjnych: aminowej i karboksylowej, jest połączona z tym samym atomem węgla.
α-Aminokwasy można otrzymać z kwasów karboksylowych w syntezie, której przebieg zilustrowano na schemacie.
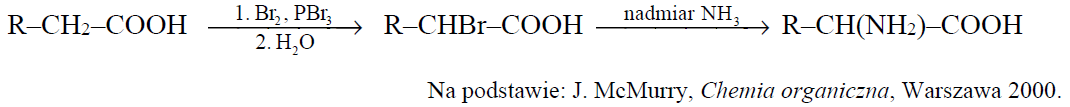
Napisz wzór półstrukturalny (grupowy) kwasu karboksylowego, którego należy użyć do otrzymania leucyny opisaną metodą, i podaj nazwę systematyczną bromopochodnej tego kwasu stanowiącej produkt pośredni w opisanej metodzie. Wzór półstrukturalny kwasu: Nazwa systematyczna bromopochodnej:
Wybór nazwy kwasu karboksylowego z którego powstał określony laktam. Zadanie 39. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Laktamy to związki, które powstają w wyniku wewnątrzcząsteczkowej kondensacji niektórych aminokwasów. W reakcji biorą udział: grupa karboksylowa i grupa aminowa znajdująca się np. przy 4., 5. lub 6. atomie węgla łańcucha aminokwasu. Przykładem laktamu jest związek o wzorze
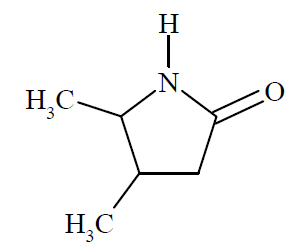
Spośród poniższych nazw wybierz nazwę aminokwasu, z którego otrzymano laktam o podanym wzorze. Zaznacz wybraną odpowiedź. A. kwas 2-amino-4-metylopentanowy B. kwas 4-amino-3,4-dimetylobutanowy C. kwas 4-amino-3-metylopentanowy D. kwas 4-metylo-4-aminopentanowy
Rysowanie wzoru grupowego tripeptydu na podstawie znajomości sekwencji jego aminokwasów. Zadanie 40. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Poniżej przedstawiono sekwencję aminokwasów pewnego tripeptydu:
Phe-Gly-Cys
Napisz wzór półstrukturalny (grupowy) tego tripeptydu. Pamiętaj, że w zastosowanej notacji umieszcza się z lewej strony kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
Jak zapisywać stopień utlenienia pierwiastka - cyfrą rzymską czy arabską?
Spotkałam się z dwoma zapisami stopniu utlenienia pierwiastków – jako cyfry rzymskie oraz arabskie. Który z tych zapisów jest poprawny. Zgłupiałam, bo zdania są podzielone.
Czy w przypadku dodatniej wartości stopnia utlenienia koniecznie trzeba pisać znak +?
Mam wątpliwości jak zapisywać dodatnią wartość stopnia utlenienia pierwiastka, mianowicie, czy np dla kationu Ca2+ pisać II, czy +2?