Określanie symboli pierwiastków chemicznych oraz najwyższych stopni utlenienia i liczby elektronów niesparowanych. Zadanie 1.1. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Pierwiastki A i X leżą w sąsiednich okresach. Wiadomo, że:
• elektrony w atomie A w stanie podstawowym są rozmieszczone w pięciu podpowłokach
• w atomie X w stanie podstawowym wszystkie elektrony biorące udział w tworzeniu wiązań są niesparowane i rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Cząsteczka tlenku pierwiastka A na najwyższym stopniu utlenienia składa się z czternastu atomów, a jej wzór rzeczywisty nie jest wzorem elementarnym. Ten tlenek w reakcji z wodą – przebiegającej bez zmiany stopni utlenienia – tworzy trójprotonowy kwas tlenowy. Liczba atomów wchodzących w skład cząsteczki wodorku pierwiastka A jest równa liczbie atomów wchodzących w skład cząsteczki tlenku pierwiastka X na najwyższym stopniu utlenienia.
Uzupełnij tabelę. Napisz symbole pierwiastków A i X – oraz dla każdego z nich – najwyższy stopień utlenienia w związkach chemicznych i liczbę elektronów niesparowanych w atomie w stanie podstawowym.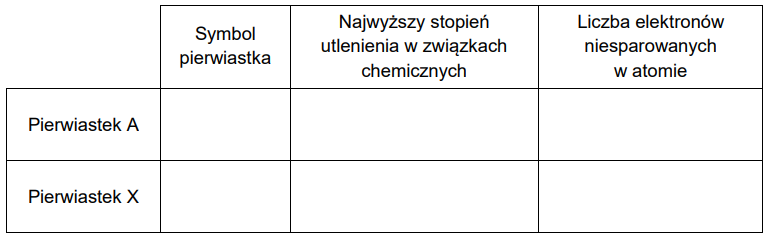
Uzupełnienie schematu klatkowego konfiguracji elektronowej. Zadanie 1.2. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Pierwiastki A i X leżą w sąsiednich okresach. Wiadomo, że:
• elektrony w atomie A w stanie podstawowym są rozmieszczone w pięciu podpowłokach
• w atomie X w stanie podstawowym wszystkie elektrony biorące udział w tworzeniu wiązań są niesparowane i rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Cząsteczka tlenku pierwiastka A na najwyższym stopniu utlenienia składa się z czternastu atomów, a jej wzór rzeczywisty nie jest wzorem elementarnym. Ten tlenek w reakcji z wodą – przebiegającej bez zmiany stopni utlenienia – tworzy trójprotonowy kwas tlenowy. Liczba atomów wchodzących w skład cząsteczki wodorku pierwiastka A jest równa liczbie atomów wchodzących w skład cząsteczki tlenku pierwiastka X na najwyższym stopniu utlenienia.
Uzupełnij poniższy schemat, tak aby przedstawiał graficzny (klatkowy) zapis konfiguracji elektronowej kationu X3+ w stanie podstawowym. W zapisie uwzględnij numery powłok i symbole podpowłok.
Zapis wzorów sumarycznych wodorku oraz tlenków i równań reakcji chemicznych. Zadanie 1.3. Arkusz CKE chemia maj 2024 rozszerzony (3 punkty)
Pierwiastki A i X leżą w sąsiednich okresach. Wiadomo, że:
• elektrony w atomie A w stanie podstawowym są rozmieszczone w pięciu podpowłokach
• w atomie X w stanie podstawowym wszystkie elektrony biorące udział w tworzeniu wiązań są niesparowane i rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Cząsteczka tlenku pierwiastka A na najwyższym stopniu utlenienia składa się z czternastu atomów, a jej wzór rzeczywisty nie jest wzorem elementarnym. Ten tlenek w reakcji z wodą – przebiegającej bez zmiany stopni utlenienia – tworzy trójprotonowy kwas tlenowy. Liczba atomów wchodzących w skład cząsteczki wodorku pierwiastka A jest równa liczbie atomów wchodzących w skład cząsteczki tlenku pierwiastka X na najwyższym stopniu utlenienia.
Uzupełnij tabelę i napisz równania reakcji: Równanie reakcji 1.: Równanie reakcji 2.:
• w formie cząsteczkowej – tlenku pierwiastka A na najwyższym stopniu utlenienia z wodą (reakcja 1.)
• w formie jonowej – tlenku pierwiastka X na najwyższym stopniu utlenienia z wodorotlenkiem potasu (reakcja 2.).
Użyj symboli A i X.
Zapis symbolu izotopu pierwiastka powstającego w wyniku przemiany beta minus. Zadanie 2.1. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Znanych jest kilkadziesiąt izotopów galu, które powstają w różnych reakcjach jądrowych, ale tylko nieliczne z nich są trwałe. Promieniotwórcze izotopy galu zwykle ulegają rozpadowi 𝛽– , jeżeli mają nadmiar neutronów, lub innym przemianom – przy niedomiarze neutronów.
Izotop galu o liczbie masowej równej 72 ulega rozpadowi 𝛽–.
Uzupełnij poniższy schemat. Wpisz symbol pierwiastka, którego izotop powstaje w wyniku opisanej przemiany, oraz liczbę masową tego izotopu.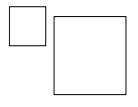
Zapis równania przemiany jądrowej. Zadanie 2.2. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Znanych jest kilkadziesiąt izotopów galu, które powstają w różnych reakcjach jądrowych, ale tylko nieliczne z nich są trwałe. Promieniotwórcze izotopy galu zwykle ulegają rozpadowi 𝛽– , jeżeli mają nadmiar neutronów, lub innym przemianom – przy niedomiarze neutronów.
Izotop 67Ga otrzymuje się w wyniku bombardowania izotopu cynku 68Zn pewnymi cząstkami. W reakcji jednego jądra 68Zn z jedną taką cząstką powstają dwa neutrony i jedno jądro 67Ga.
Napisz równanie opisanej przemiany, której ulega jądro izotopu 68Zn. Uzupełnij wszystkie pola w poniższym schemacie.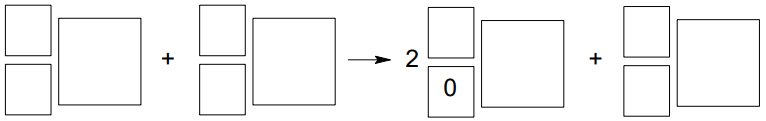
Wybór właściwych określeń związanych z energią sieciową oraz temperaturą topnienia dwóch związków chemicznych. Zadanie 3. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Energia sieciowa związków jonowych to ilość energii potrzebna do rozłożenia jednego mola krystalicznej substancji na jony leżące nieskończenie daleko od siebie. Jej wartość zależy od rozmiarów jonów i ich ładunków. Wraz ze wzrostem energii sieciowej rosną wartości temperatury topnienia substancji krystalicznych. W tabeli przedstawiono wartości energii sieciowej halogenków wybranych litowców.
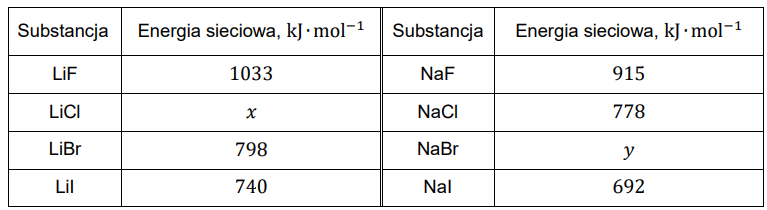
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Energia sieciowa 𝑥 chlorku litu wynosi około (640 / 740 / 840) kJ∙mol–1, a energia sieciowa 𝑦 bromku sodu wynosi około (640 / 740 / 840) kJ∙mol–1. Temperatura topnienia chlorku sodu jest równa 801 °C, a temperatura topnienia jodku sodu jest równa (662 / 882) °C.
Wyjaśnienie przyczyny różnic energii sieciowej MgO oraz LiF. Zadanie 4. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Energia sieciowa związków jonowych to ilość energii potrzebna do rozłożenia jednego mola krystalicznej substancji na jony leżące nieskończenie daleko od siebie. Jej wartość zależy od rozmiarów jonów i ich ładunków. Wraz ze wzrostem energii sieciowej rosną wartości temperatury topnienia substancji krystalicznych. W tabeli przedstawiono wartości energii sieciowej halogenków wybranych litowców.

W poniższej tabeli przedstawiono wartości energii sieciowej dwóch związków oraz promieni tworzących je jonów.
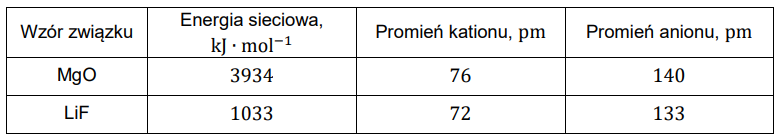
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Wyjaśnij, dlaczego – mimo zbliżonych rozmiarów jonów – energia sieciowa tlenku magnezu różni się znacznie od energii sieciowej fluorku litu.
Wybór właściwych określeń dotyczących struktur krystalicznych tlenku germanu(IV). Zadanie 5. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Liczba koordynacyjna to liczba najbliższych atomów lub jonów otaczających dany atom lub jon w sieci krystalicznej kryształu. Tlenek germanu(IV) jest krystalicznym ciałem stałym. Istnieje w dwóch odmianach: alfa, α-GeO2, oraz beta, β-GeO2. Fragmenty struktur obu odmian przedstawiono poniżej (atomy Ge – szare, atomy O – czerwone).
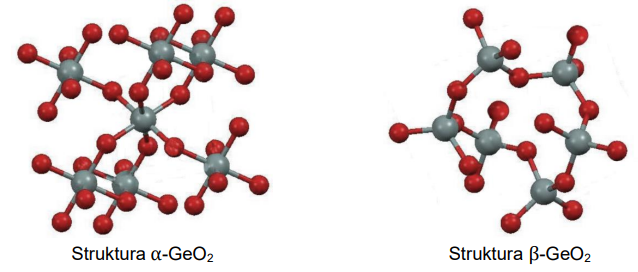
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. W odmianie α-GeO2 liczba koordynacyjna dla atomu germanu wynosi (dwa / cztery / sześć). W strukturze odmiany β-GeO2 dla orbitali walencyjnych atomu germanu zakłada się
hybrydyzację (sp2 / sp3).