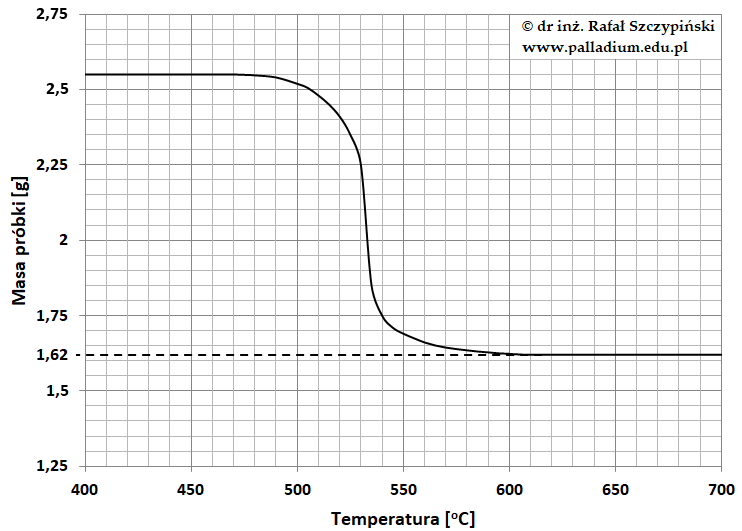
Przerwana reakcja rozkładu manganianu(VII) potasu
Odważono 3,95 g manganianu(VII) potasu i poddano termicznemu rozkładowi zgodnie z równaniem:
2KMnO4 ⟶ K2MnO4 + MnO2 + O2
Po zakończeniu doświadczenia stwierdzono, że w mieszaninie poreakcyjnej substancji stałych związek ten stanowił 21,8% masy.
Ile cm³ (warunki normalne) tlenu powstało? Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Pajączek "Węglowodory i halogenopochodne" - rysowanie wzorów grupowych
Rysunek poniżej ilustruje schemat kilkunastu przemian chemicznych z udziałem oznaczonych literami A÷M związków organicznych. Substancje te są głównymi (uprzywilejowanymi) produktami opisanych przemian.
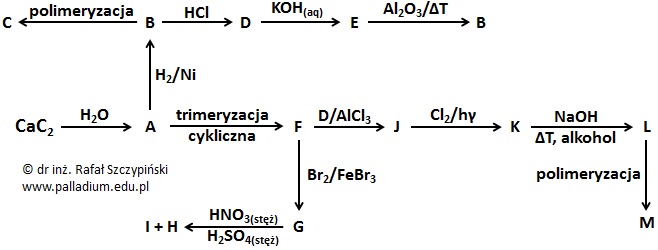
Narysuj wzory półstrukturalne (grupowe) cząsteczek związków chemicznych A÷M. W przypadku substancji C i M narysuj fragment cząsteczki zawierający jeden mer. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór związków organicznych spełniających określone kryteria
Rysunek poniżej ilustruje schemat kilkunastu przemian chemicznych z udziałem oznaczonych literami A÷M związków organicznych. Substancje te są głównymi (uprzywilejowanymi) produktami opisanych przemian.

Uzupełnij poniższą tabelę oznaczeniami literowymi A÷M, przypisanymi do odpowiednich związków chemicznych spełniających warunki opisane w tabeli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone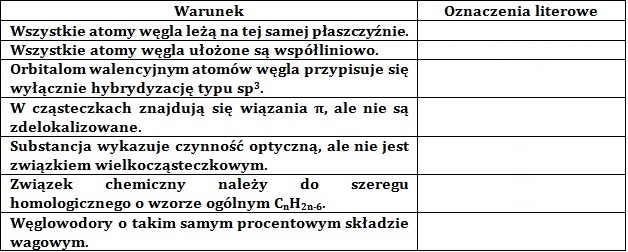
Ocena poprawności zdań dotyczących przemian chemicznych przedstawionych schematem
Rysunek poniżej ilustruje schemat kilkunastu przemian chemicznych z udziałem oznaczonych literami A÷M związków organicznych. Substancje te są głównymi (uprzywilejowanymi) produktami opisanych przemian.

Oceń poprawność poniższych zdań dotyczących przemian przedstawionych schematem w informacji wprowadzającej. Wpisz literę „P” (prawda) lub literę „F” (fałsz). 1. Przemianie CaC2 ⟶ A przypisuje się ujemną wartość efektu cieplnego. 2. Podczas przemiany J ⟶ K światło pełni rolę katalizatora, natomiast w przemianie F ⟶ G katalizatorem jest wykorzystane żelazo. 3. Przemiana B ⟶ D przebiega według mechanizmu nukleofilowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie procentu wagowego jonów wapnia w mieszaninie poreakcyjnej uzyskanej w wyniku częściowego rozkładu węglanu wapnia
W otwartym naczyniu prowadzono termiczny rozkład 4 g węglanu wapnia. Po pewnym czasie reakcję przerwano, stwierdzając, że stopień przereagowania substratu wynosi 30%.
Oblicz zawartość jonów wapnia w poreakcyjnej mieszaninie substancji stałych. Wynik wyraź w procentach wagowych, stosując przybliżenie do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego mieszaniny hydratów siarczanu(VI) miedzi(II) poddanej prażeniu
Z pojemnika zawierającego 250 g mieszaniny dwóch hydratów: CuSO4 · 3H2O oraz CuSO4 · 5H2O odważono dwie próbki o masie 7,32 g każda. Pierwszą z nich umieszczono w tyglu porcelanowym, a drugą rozłożono równomiernie na ceramicznej płytce wykonanej z tego samego materiału, co tygiel. Obie próbki wprowadzono do pieca i poddano całkowitemu odwodnieniu w temperaturze 170 oC. Po zakończeniu doświadczenia stwierdzono, że masy uzyskanych w obu naczyniach białych substancji stałych stanowiły po 65,6% masy każdej z mieszanin poddanych prażeniu.
Oblicz procentowy skład wagowy mieszaniny hydratów poddanej odwodnieniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie w jakim stosunku molowym zmieszano propano-1-aminę z butano-1-aminą (miareczkowanie)
Próbkę o masie 2,57 g stanowiącą propano-1-aminę oraz butano-1-aminę wprowadzono do wody destylowanej i przeprowadzono miareczkowanie wykorzystując 90 cm3 roztworu kwasu bromowodorowego o stężeniu 0,5 mol∙dm–3. Nadmiar kwasu zobojętniono za pomocą 62,5 cm3 0,08-molowego roztworu wodorotlenku potasu.
Na podstawie niezbędnych obliczeń ustal, w jakim stosunku molowym pozostawały względem siebie aminy w próbce poddanej miareczkowaniu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie odczynu roztworu w punkcie równoważnikowym miareczkowania roztworu etanoaminy z uzasadnieniem
Miareczkowano wodny roztwór etanoaminy zawierający 150 mg tej substancji chemicznej. Jako titrant zastosowano 0,1-molowy roztwór kwasu solnego. Punkt równoważnikowy osiągnięto, gdy objętość zmiareczkowanego roztworu była równa 250 cm3.
Określ, jaki odczyn (kwasowy, zasadowy czy obojętny) miał roztwór uzyskany w punkcie równoważnikowym miareczkowania? Odpowiedź uzasadnij równaniem chemicznym przebiegającego procesu, zapisanym w formie jonowej skróconej. Odczyn roztworu w punkcie równoważnikowym: Uzasadnienie: Wskaż sprzężone (zgodnie z teorią Brønsteda) pary kwas-zasada (uzupełnij tabelę): © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone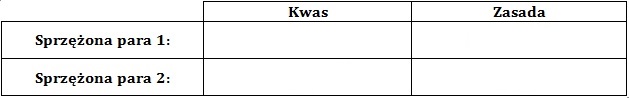
Obliczanie wartości pH roztworu etyloaminy poddanego miareczkowaniu (miareczkowanie)
Miareczkowano wodny roztwór etanoaminy zawierający 150 mg tej substancji chemicznej. Jako titrant zastosowano 0,1-molowy roztwór kwasu solnego. Punkt równoważnikowy osiągnięto, gdy objętość zmiareczkowanego roztworu była równa 250 cm3.
Pomijając zjawisko kontrakcji, oblicz wartość pH roztworu etanoaminy poddanego miareczkowaniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone