Określanie rodzaju sporządzonego roztworu (rozpuszczalność substancji)
Rysunek poniżej ilustruje charakterystyki zmian rozpuszczalności chlorowodoru oraz azotanu(V) ołowiu(II) w 100 g wody, w zakresie temperatur 0 ⁰C ÷ 100 ⁰C, pod ciśnieniem 1013 hPa.
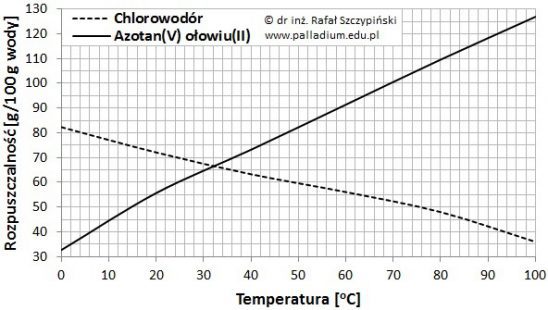
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W temperaturze 25 ⁰C przygotowano 80 g wodnego roztworu azotanu(V) ołowiu(II), przy czym w roztworze tym stosunek wagowy soli do rozpuszczalnika wynosił 1:2.
Określ, czy uzyskano roztwór nasycony, czy nienasycony? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń na podstawie wykresów rozpuszczalności (rozpuszczalność substancji)
Rysunek poniżej ilustruje charakterystyki zmian rozpuszczalności chlorowodoru oraz azotanu(V) ołowiu(II) w 100 g wody, w zakresie temperatur 0 ⁰C ÷ 100 ⁰C, pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Handlowo dostępny kwas solny jest wodnym roztworem (HBr/HCl/HI/HF) o stężeniu 38%. Jest to roztwór nasycony w temperaturze około (25/35/45/55) ⁰C. W identycznych warunkach temperaturowych, mieszanina złożona ze 100 g wody i 60 g rozpuszczonego w niej Pb(NO3)2 jest roztworem (nasyconym/nienasyconym), o stężeniu soli bliskim (38/44/52/60) %. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzyskiwanie roztworu nasyconego na drodze odparowania rozpuszczalnika (rozpuszczalność substancji)
W temperaturze 20 ⁰C rozpuszczalność siarczanu(VI) sodu wynosi 19,1 g/100 g wody. 100 ml roztworu kwasu siarkowego(VI) o stężeniu 30% i gęstości 1,22 g/cm3 poddano reakcji z taką ilością 10% roztworu wodorotlenku sodu, że nastąpiło całkowite zobojętnienie kwasu.
Oblicz, jaką ilość wody należy odparować z uzyskanego w wyniku zobojętnienia kwasu siarkowego(VI) roztworu, aby otrzymać nasycony w tej temperaturze roztwór soli? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis nazwy systematycznej p-nitrotoluenu
Przeprowadzono ciąg kilku reakcji chemicznych, co ilustruje schemat:
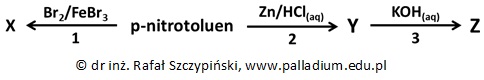
Podaj nazwę systematyczną p-nitrotoluenu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru grupowego głównego produktu reakcji bromowania p-nitrotoluenu oraz jego nazwy
Przeprowadzono ciąg kilku reakcji chemicznych, co ilustruje schemat:

Związek chemiczny X jest głównym organicznym produktem reakcji oznaczonej numerem 1.
Narysuj wzór grupowy jego cząsteczki i podaj nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilans jonowo-elektronowy reakcji chemicznej z udziałem p-nitrotoluenu, cynku i kwasu solnego
Przeprowadzono ciąg kilku reakcji chemicznych, co ilustruje schemat:

Napisz w formie jonowej skróconej równanie reakcji chemicznej oznaczonej na schemacie numerem 2. Współczynniki uzgodnij metodą bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności stwierdzeń dotyczących schematu reakcji z udziałem p-nitrotoluenu
Przeprowadzono ciąg kilku reakcji chemicznych, co ilustruje schemat:

Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Odczynnikiem elektrofilowym biorącym udział w procesie oznaczonym cyfrą 1 jest cząsteczka bromu. 2. Związek chemiczny X jest substancją trudno rozpuszczalną w wodzie. 3. Reakcja oznaczona cyfrą 3 nie jest procesem redoks. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barw papierka wskaźnikowego oraz nazw procesów, jakie są tego przyczyną
Przeprowadzono ciąg kilku reakcji chemicznych, co ilustruje schemat:

Sporządzono wodne roztwory związków Y i Z o identycznym stężeniu molowym.
Określ barwy zanurzonych w nich uniwersalnych papierków wskaźnikowych. Podaj nazwy procesów, jakie odpowiadają za wskazane przez Ciebie kolory. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości powstałego azotu w przerwanej reakcji rozkładu dwuchromianu(VI) amonu
Reakcję termicznego rozkładu dwuchromianu(VI) amonu przedstawia równanie stechiometryczne:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Rozkładowi poddano 3,15 g substratu.
Oblicz objętość azotu (800 K, 1010 hPa) jaka powstała w tym doświadczeniu, jeśli w poreakcyjnej mieszaninie substancji stałych tlenek chromu(III) stanowił 70,7% masy. Wynik podaj w centymetrach sześciennych z przybliżeniem do cyfry jedności. Przyjmij, że uniwersalna stała gazowa ma wartość równą 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, jaki procent początkowej ilości substratu uległ rozkładowi, gdy przerwano reakcję chemiczną
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Oblicz, jaki procent masy dwuchromianu(VI) amonu uległ rozkładowi? Wynik podaj z dokładnością do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości wydzielonego azotu do momentu wstrzymania reakcji rozkładu dwuchromianu(VI) amonu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Oblicz, jaką objętość (w przeliczeniu na warunki normalne) zajął powstały azot? Wynik podaj w centymetrach sześciennych z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Stosunek molowy stałych składników w mieszaninie poreakcyjnej po przerwaniu reakcji rozkładu dwuchromianu(VI) amonu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Oblicz, w jakim stosunku molowym pozostawały względem siebie stałe składniki w uzyskanej mieszaninie poreakcyjnej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stopnia przereagowania manganianu(VII) potasu w reakcji jego rozkładu
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek poniżej.
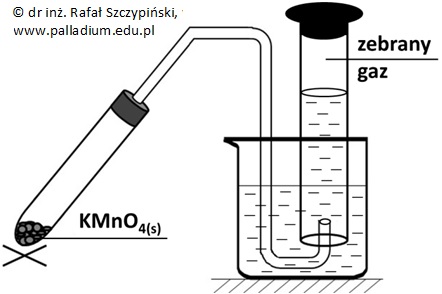
Rozkładowi termicznemu poddano próbkę manganianu(VII) potasu o masie 7,11 g. Wydzielający się gaz zbierano w cylindrze miarowym o pojemności 1 dm3, przy czym reakcję przerwano w momencie, gdy gaz stanowił 49,8% pojemności naczynia (80 oC, 1031 hPa). Opisana reakcja rozkładu przebiegła zgodnie z równaniem stechiometrycznym:
2KMnO4 ⟶ K2MnO4 + MnO2 + O2↑
Oblicz stopień przereagowania manganianu(VII) potasu do chwili, gdy przerwano rozkład tego związku chemicznego. Wynik podaj w procentach z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zawartości procentowej tlenku manganu(IV) w mieszaninie uzyskanej po przerwaniu reakcji rozkładu manganianu(VII) potasu
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek poniżej.

Rozkładowi termicznemu poddano próbkę manganianu(VII) potasu o masie 7,11 g. Wydzielający się gaz zbierano w cylindrze miarowym o pojemności 1 dm3, przy czym reakcję przerwano w momencie, gdy gaz stanowił 49,8% pojemności naczynia (80 oC, 1031 hPa). Opisana reakcja rozkładu przebiegła zgodnie z równaniem stechiometrycznym:
2KMnO4 ⟶ K2MnO4 + MnO2 + O2↑
Oblicz procent wagowy tlenku manganu(IV) w mieszaninie ciał stałych, jaka znajdowała się w probówce po przerwaniu ogrzewania jej zawartości. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

