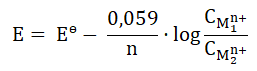Obliczanie niezbędnej ilości substratu użytego w wieloetapowym procesie. Temat I - wydajność reakcji, proces wieloetapowy
Podczas reakcji kwasu siarkowego(VI) z chloranem(V) potasu powstaje nietrwały kwas chlorowy(V), który rozkłada się zgodnie z równaniem:
3HClO3 → 2ClO2 + HClO4 + H2O
Z uwagi na wybuchowy charakter rozkładu tlenku chloru(IV) w temperaturze bliskiej 333 K, konieczne jest zapewnienie stałej temperatury (273 K) układu reakcyjnego:
2ClO2 → Cl2 + 2O2
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz, jaką masę chloranu(V) potasu należy odważyć, aby przy wydajności każdego z etapów reakcyjnych równej 90%, otrzymać 14 dm3 chloru odmierzonego w warunkach normalnych? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, czy powstanie wystarczająca ilość azotu przeznaczonego do reakcji syntezy amoniaku. Temat I - wydajność reakcji
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Wykonując stosowne obliczenia określ, czy ilość azotu wydzielona w wyniku całkowitego rozkładu 12,6 g dwuchromianu(VI) amonu będzie wystarczająca, aby w reakcji z wodorem możliwe było uzyskanie z 75% wydajnością 1 dm3 amoniaku (w przeliczeniu na warunki normalne)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie minimalnej objętości wody użytej w reakcji z azotkiem magnezu. Temat I - wydajność reakcji, proces wieloetapowy
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku (rysunek obok). Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
Załóżmy, że wydajność pierwszego etapu reakcyjnego wyniosła 100%, natomiast w drugim etapie reakcja biegła z 95% wydajnością.
Oblicz, jakiej minimalnej objętości wody (warunki normalne) należałoby użyć, w celu całkowitego przereagowania azotku magnezu? Wynik obliczeń podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Procentowa wydajność reakcji syntezy tlenku siarki(VI) obliczona na podstawie składu ilościowego mieszaniny reagentów. Temat I - wydajność reakcji
Ułamkiem molowym składnika mieszaniny nazywa się stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny. W wyniku prowadzonej w obecności katalizatora reakcji tlenu z tlenkiem siarki(IV) powstaje tlenek siarki(VI). Przygotowano 51,2 g mieszaniny substratów, w której procent wagowy tego o mniejszej masie cząsteczkowej wynosił 25%.
Oblicz procentową wydajność opisanej przemiany, jeśli ułamek molowy produktu w poreakcyjnej mieszaninie reagentów równy był 0,2. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru hydratu chlorku żelaza(III) na podstawie kilku reakcji następczych. Temat I - wydajność reakcji, proces wieloetapowy
W celu ustalenia wzoru hydratu chlorku żelaza(III) na wodny roztwór powstały w wyniku rozpuszczenia 4,51 g tego hydratu podziałano nadmiarową ilością roztworu wodorotlenku sodu. Osad przemyto, wyprażono i zważono. Masa uzyskanego w ten sposób tlenku żelaza(III) wynosiła 1,06 g.
Określ wzór hydratu, jeśli całkowita wydajność procesu prowadzącego do otrzymania tlenku wyniosła 80%. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
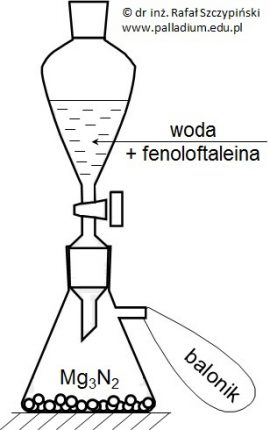
Zapis sumarycznego równania reakcji przebiegającej w ogniwie chemicznym zbudowanym z półogniw redoks
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz sumaryczne równanie reakcji chemicznej przebiegającej podczas pracy tego ogniwa oraz oblicz jego SEM w stanie standardowym. Równanie reakcji: SEM: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór jonu będącego najsilniejszym utleniaczem oraz zapis barwy roztworu
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Spośród jonów potencjałotwórczych znajdujących się w opisanym ogniwie chemicznym wybierz i napisz wzór sumaryczny tego, który jest najsilniejszym utleniaczem. Określ barwę roztworu związku chemicznego zawierającego wybrany przez Ciebie jon, jeśli w układzie nie będzie obecna żadna inna drobina nadająca zabarwienie. Wzór jonu: Barwa roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie potencjału redoks półogniwa dla różnych stężeń molowych jonów potencjałotwórczych
Wartość potencjału redoks półogniwa Pt|Fe2+, Fe3+ zależy od stężenia molowego każdego z jonów (Fe2+ oraz Fe3+) i w temperaturze 25 oC wyraża się zależnością zwaną równaniem Nernsta w postaci:
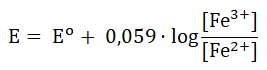
W wyrażeniu tym Eo to standardowy potencjał redoks półogniwa o wartości 0,771 V, natomiast [Fe3+] oraz [Fe2+] są stężeniami molowymi jonów potencjałotwórczych.
W temperaturze 25 oC zbudowano ogniwo chemiczne z dwóch półogniw Pt|Fe2+, Fe3+. W pierwszym z nich stężenie jonów Fe3+ było takie samo jak stężenie jonów Fe2+ w drugim półogniwie i wynosiło 0,5 mol·dm–3. Stężenia pozostałych jonów potencjałotwórczych w tych półogniwach odpowiadały stężeniu jonów chlorkowych w roztworze HCl o pH = 2.
Oblicz SEM opisanego ogniwa chemicznego w temperaturze 25 oC. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stałej równowagi reakcji przebiegającej w ogniwie cynkowo-kadmowym
W stanie równowagi (gdy ogniwo chemiczne uległo wyczerpaniu) standardową siłę elektromotoryczną ogniwa w temperaturze 298 K opisuje wyrażenie:
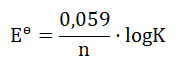
Wielkość K to stała równowagi reakcji redoks przebiegającej podczas pracy ogniwa, natomiast n to liczba moli elektronów wymienionych między utleniaczem i reduktorem.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz stałą równowagi reakcji w temperaturze 298 K, przebiegającej w pracującym ogniwie zbudowanym z półogniw – cynkowego oraz kadmowego. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości gazowych produktów reakcji rozkładu w różnych warunkach. Temat I - skład mieszaniny w reakcjach chemicznych
W skład proszku do pieczenia wchodzą zwykle dwa związki chemiczne – wodorowęglan sodu (soda oczyszczona) lub wodorowęglan amonu (tzw. amoniak do pieczenia). W temperaturze wypieku równej 180 oC oba rozkładają się z wydzieleniem gazowych produktów, przy czym podczas rozkładu sody oczyszczonej powstaje dodatkowo związek chemiczny o stałym stanie skupienia, zawierający 43,4% sodu.
Do wypieku 600 g ciasta (1000 hPa) wykorzystano 15 g wodorowęglanu amonu. Gazowe produkty reakcji jego rozkładu spowodowały spulchnienie ciasta.
Jaką objętość będą zajmować poszczególne produkty rozkładu wodorowęglanu amonu w warunkach normalnych oraz w warunkach wypieku ciasta? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących doświadczenia z udziałem roztworu wodorotlenku potasu i kwasu siarkowego(VI)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Podczas rozcieńczania do objętości 150 cm3 roztworu zawierającego produkt reakcji tlenku potasu z wodą wartość pH roztworu maleje. 2. Próbka roztworu o objętości 20 cm3 pobrana z roztworu o objętości 150 cm3 ma niższą od tego roztworu wartość pH. 3. Produkt reakcji zobojętniania jest solą pochodzącą od dwuprotonowego słabego kwasu i dlatego ulega on hydrolizie kationowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnej kolejności wodnych roztworów w zależności od stężenia jonów wodorowych
W pięciu kolbach miarowych (250 cm3 każda) umieszczono 0,5-molowe, wodne roztwory następujących związków chemicznych:
1) NaOH 2) HCOOH 3) HCl 4) H2SO4 5) NH3
Uszereguj wymienione roztwory według wzrastającego stężenia jonów wodorowych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone