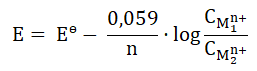Zapis równań reakcji dysocjacji kwasu ortofosforowego(V) oraz wybór anionu o najwyższym i najniższym stężeniu molowym
Wartość pH roztworów słabych, wieloprotonowych kwasów zależy praktycznie wyłącznie od stężenia jonów wodorowych powstałych w pierwszym etapie dysocjacji kwasu. Przykładem takiego związku chemicznego jest kwas ortofosforowy(V), którego wartość stałej równowagi dysocjacji elektrolitycznej (25 ⁰C) w pierwszym etapie wynosi 7,1∙10–3, a w kolejnych równa jest odpowiednio 6,3∙10–8 oraz 4,4∙10–13.
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz, stosując teorię Brønsteda-Lowry’ego równania procesu dysocjacji elektrolitycznej kwasu ortofosforowego(V). Następnie określ wzór sumaryczny tego jonu zawierającego atom fosforu, którego stężenie molowe jest najwyższe oraz tego o najniższym stężeniu molowym w wodnym roztworze kwasu ortofosforowego(V). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie całkowitej wydajności procesu wieloetapowego (wydajność reakcji)
Pewien związek chemiczny X uzyskuje się w trójetapowym procesie chemicznym:
Etap 1: A + B → 2C + D
Etap 2: C + E → F
Etap 3: 3F + 2Y → 2X + G
Oblicz całkowitą wydajność procesu prowadzącego do utworzenia związku chemicznego X, jeśli wydajności poszczególnych etapów reakcyjnych wynoszą kolejno: 70%, 90% oraz 65%. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości pierwiastka uzyskanego w wieloetapowym procesie reakcyjnym (wydajność reakcji)
Tak zwany antymon metaliczny otrzymuje się w dwuetapowym procesie reakcyjnym, z wyjściowego surowca, jakim jest siarczek antymonu(III) – antymonit:
Sb2S3 + 5O2 → Sb2O4 + 3SO2 (etap I)
Sb2O4 + 4C → 2Sb + 4CO (etap II)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Uzasadnij obliczeniami, czy przy wydajności równej 90% każdego etapu reakcyjnego, możliwe jest uzyskanie 210 g antymonu, jeśli dysponujemy 400 g rudy o zawartości 85% antymonitu? Wynik zaokrąglij do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie niezbędnej ilości substratu użytego w wieloetapowym procesie (wydajność reakcji)
Podczas reakcji kwasu siarkowego(VI) z chloranem(V) potasu powstaje nietrwały kwas chlorowy(V), który rozkłada się zgodnie z równaniem:
3HClO3 → 2ClO2 + HClO4 + H2O
Z uwagi na wybuchowy charakter rozkładu tlenku chloru(IV) w temperaturze bliskiej 333 K, konieczne jest zapewnienie stałej temperatury (273 K) układu reakcyjnego:
2ClO2 → Cl2 + 2O2
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz, jaką masę chloranu(V) potasu należy odważyć, aby przy wydajności każdego z etapów reakcyjnych równej 90%, otrzymać 14 dm3 chloru odmierzonego w warunkach normalnych? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, czy powstanie wystarczająca ilość azotu przeznaczonego do reakcji syntezy amoniaku (wydajność reakcji)
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Wykonując stosowne obliczenia określ, czy ilość azotu wydzielona w wyniku całkowitego rozkładu 12,6 g dwuchromianu(VI) amonu będzie wystarczająca, aby w reakcji z wodorem możliwe było uzyskanie z 75% wydajnością 1 dm3 amoniaku (w przeliczeniu na warunki normalne)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis sumarycznego równania reakcji przebiegającej w ogniwie chemicznym zbudowanym z półogniw redoks
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz sumaryczne równanie reakcji chemicznej przebiegającej podczas pracy tego ogniwa oraz oblicz jego SEM w stanie standardowym. Równanie reakcji: SEM: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór jonu będącego najsilniejszym utleniaczem oraz zapis barwy roztworu
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Spośród jonów potencjałotwórczych znajdujących się w opisanym ogniwie chemicznym wybierz i napisz wzór sumaryczny tego, który jest najsilniejszym utleniaczem. Określ barwę roztworu związku chemicznego zawierającego wybrany przez Ciebie jon, jeśli w układzie nie będzie obecna żadna inna drobina nadająca zabarwienie. Wzór jonu: Barwa roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie potencjału redoks półogniwa dla różnych stężeń molowych jonów potencjałotwórczych
Wartość potencjału redoks półogniwa Pt|Fe2+, Fe3+ zależy od stężenia molowego każdego z jonów (Fe2+ oraz Fe3+) i w temperaturze 25 oC wyraża się zależnością zwaną równaniem Nernsta w postaci:
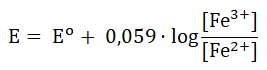
W wyrażeniu tym Eo to standardowy potencjał redoks półogniwa o wartości 0,771 V, natomiast [Fe3+] oraz [Fe2+] są stężeniami molowymi jonów potencjałotwórczych.
W temperaturze 25 oC zbudowano ogniwo chemiczne z dwóch półogniw Pt|Fe2+, Fe3+. W pierwszym z nich stężenie jonów Fe3+ było takie samo jak stężenie jonów Fe2+ w drugim półogniwie i wynosiło 0,5 mol·dm–3. Stężenia pozostałych jonów potencjałotwórczych w tych półogniwach odpowiadały stężeniu jonów chlorkowych w roztworze HCl o pH = 2.
Oblicz SEM opisanego ogniwa chemicznego w temperaturze 25 oC. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stałej równowagi reakcji przebiegającej w ogniwie cynkowo-kadmowym
W stanie równowagi (gdy ogniwo chemiczne uległo wyczerpaniu) standardową siłę elektromotoryczną ogniwa w temperaturze 298 K opisuje wyrażenie:
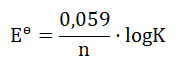
Wielkość K to stała równowagi reakcji redoks przebiegającej podczas pracy ogniwa, natomiast n to liczba moli elektronów wymienionych między utleniaczem i reduktorem.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz stałą równowagi reakcji w temperaturze 298 K, przebiegającej w pracującym ogniwie zbudowanym z półogniw – cynkowego oraz kadmowego. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
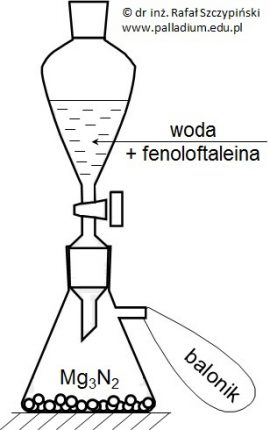
Ocena poprawności zdań dotyczących doświadczenia z udziałem roztworu wodorotlenku potasu i kwasu siarkowego(VI)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Podczas rozcieńczania do objętości 150 cm3 roztworu zawierającego produkt reakcji tlenku potasu z wodą wartość pH roztworu maleje. 2. Próbka roztworu o objętości 20 cm3 pobrana z roztworu o objętości 150 cm3 ma niższą od tego roztworu wartość pH. 3. Produkt reakcji zobojętniania jest solą pochodzącą od dwuprotonowego słabego kwasu i dlatego ulega on hydrolizie kationowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone