Przypisywanie krzywej zależności pH od stężenia kwasu odpowiedniemu roztworowi
Zmierzono wartości pH wodnych roztworów trzech kwasów oznaczonych kolejnymi literami alfabetu (A, B, C). Pomiarów dokonano w temperaturze 25 oC, w zakresie stężeń 10–6÷10–1 mol·dm–3, a wyniki eksperymentu przedstawiono w postaci graficznej.
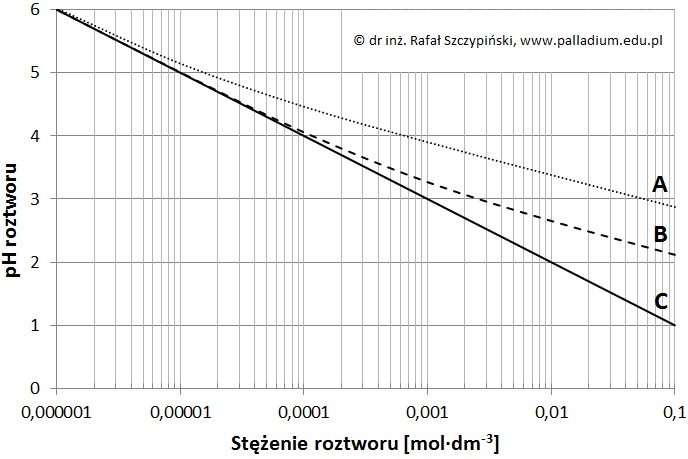
Spośród podanych niżej kwasów wybierz i przyporządkuj literom A, B i C opisującym krzywe na wykresie wzory trzech, których wodne roztwory poddano pomiarom wartości pH: C6H5OH, HBr, HF, CH3COOH. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego kwasu na podstawie odczytanej z wykresu wartości pH roztworu
Zmierzono wartości pH wodnych roztworów trzech kwasów oznaczonych kolejnymi literami alfabetu (A, B, C). Pomiarów dokonano w temperaturze 25 oC, w zakresie stężeń 10–6÷10–1 mol·dm–3, a wyniki eksperymentu przedstawiono w postaci graficznej.

Wartość pH pewnego roztworu kwasu mlekowego jest identyczna z wartością pH 0,0006-molowego roztworu najsłabszego z kwasów, których roztwory poddano pomiarom.
Podaj oznaczenie literowe (A, B lub C) kwasu o którym jest mowa, a następnie oblicz stężenie molowe roztworu kwasu mlekowego, któremu odpowiada odczytana przez Ciebie wartość pH. Wartość Ka kwasu mlekowego w temperaturze 25 oC wynosi 1,35·10–4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wypieranie metalu z roztworu soli za pomocą innego metalu (blaszki), obliczanie stężenia molowego
W zlewce umieszczono 50 cm3 roztworu azotanu(V) srebra i zanurzono w nim blaszkę cynkową. Po 24 godzinach blaszkę wyjęto, przemyto i wysuszono. Po jej zważeniu stwierdzono przyrost masy równy 3,02 g.
Wiedząc, że całe srebro zostało usunięte z roztworu oblicz stężenie molowe jonów azotanowych(V). Wynik podaj z dokładnością do jednego miejsca po przecinku. Przyjmij, że objętość roztworu przed i po zakończeniu doświadczenia była taka sama. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wypieranie metalu z roztworu soli za pomocą innego metalu (blaszki), obliczanie stężenia molowego
W roztworze azotanu(V) bizmutu(III) o objętości równej 200 cm3 zanurzono płytkę niklową o masie 29,5 g. Po całkowitym usunięciu jonów Bi3+ z roztworu stwierdzono, że masa płytki wynosi 32 g.
Oblicz, jakie było stężenie jonów bizmutu(III) przed reakcją oraz jakie było stężenie jonów niklu(II) po jej zakończeniu? Wyniki obliczeń podaj z dokładnością do trzeciego miejsca po przecinku. Przyjmij, że objętość roztworu przed i po zakończeniu doświadczenia była taka sama. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego roztworu azotanu(V) srebra użytego do posrebrzenia przedmiotu (blaszki)
W celu poprawienia estetyki, przedmioty wykonane z żelaza pokrywa się cienką warstwą metalicznego srebra, czemu towarzyszy przebieg reakcji chemicznej opisanej równaniem:
Fe + 3Ag+ → Fe3+ + 3Ag
W wodnym roztworze azotanu(V) srebra o objętości równej 485 cm3 całkowicie zanurzono żelazny przedmiot o masie 20 g.
Oblicz, jakie powinno być stężenie molowe opisanego roztworu azotanu(V) srebra, aby osadzone srebro stanowiło dokładnie 5% masy posrebrzonego nim przedmiotu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu stanowiącego przesącz po reakcji strącania siarczanu(VI) baru
W kolbie o pojemności 400 cm3 umieszczono 100 cm3 roztworu chlorku baru o stężeniu 0,2 mol∙dm-3. Do zawartości naczynia wprowadzono następnie stechiometryczną ilość 0,4-molowego roztworu kwasu siarkowego(VI), co poskutkowało przebiegiem reakcji chemicznej, którą można opisać równaniem:
BaCl2 + H2SO4 ⟶ BaSO4↓ + 2HCl
Powstały osad odsączono, a przesącz ponownie umieszczono w kolbie o wyjściowej pojemności i uzupełniono wodą destylowaną do połowy pojemności naczynia.
Oblicz wartość pH uzyskanego w kolbie po zakończeniu doświadczenia roztworu. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu powstałego w wyniku reakcji tlenku potasu z wodą
Do 100 cm3 wody destylowanej wprowadzono 3,76 g tlenku potasu i kilkukrotnie energicznie wstrząśnięto. Uzyskany roztwór rozcieńczono wodą destylowaną do objętości 400 cm3.
Oblicz wartość pH powstałego w ten sposób roztworu wodorotlenku potasu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu kwasu siarkowego(VI) z uwzględnieniem obu etapów dysocjacji elektrolitycznej
Kwas siarkowy(VI) ulega dwuetapowej dysocjacji elektrolitycznej:
H2SO4 + H2O → HSO4– + H3O+ Ka1 = 103
HSO4– + H2O ⇄ SO42– + H3O+ Ka2 = 1,02·10–2
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013 oraz K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Do 160 cm3 0,1-molowego roztworu wodorotlenku potasu wprowadzono 40 cm3 roztworu kwasu siarkowego(VI) o stężeniu 0,4 mol∙dm–3.
Oblicz wartość pH wykorzystanego w tym doświadczeniu roztworu kwasu siarkowego(VI), uwzględniając dwuetapową jego dysocjację. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości roztworu kwasu o określonej wartości pH, w celu roztworzenia magnezu
Reakcję kwasu etanowego (octowego) z magnezem ilustruje równanie stechiometryczne:
2CH3COOH + Mg ⟶ (CH3COO)2Mg + H2
Oblicz, jakiej objętości roztworu kwasu octowego o wartości pH równej 2,7 należy użyć, w celu roztworzenia 3 g wiórek magnezowych? Wynik obliczeń podaj w centymetrach sześciennych z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone