Rysowanie odpowiednich stereoizomerów będących alkenami (izomeria optyczna, izomeria geometryczna)
Pewien alken A oraz jego izomer konstytucyjny B tworzą różnego typu stereoizomery. Pierwszy z nich występuje wyłącznie w postaci pary enancjomerów, natomiast drugi jako para izomerów geometrycznych. Addycja wodoru w obecności katalizatora niklowego do związków A i B daje ten sam nieczynny optycznie produkt C. Związki chemiczne A i B są najlżejszymi alkenami spełniającymi opisane warunki.
Narysuj stereoizomery związków chemicznych A i B, aby w sposób jednoznaczny wskazywały na rodzaj występującej w ich cząsteczkach izomerii przestrzennej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilansowanie równania reakcji utleniania jonu azotanowego(III) nadtlenkiem wodoru
W probówce umieszczono wodny roztwór azotanu(III) sodu z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. Do układu wprowadzono następnie stechiometryczną ilość wody utlenionej i zaobserwowano zmianę świadczącą o przebiegu reakcji chemicznej.
Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła w probówce po dodaniu wody utlenionej do jej zawartości. Współczynniki uzgodnij metodą bilansu jonowo-elektronowego, uwzględniając odczyn znajdującego się w naczyniu przed rozpoczęciem reakcji wodnego roztworu soli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru półstrukturalnego związku chemicznego będącego wspólnym produktem reakcji (izomeria optyczna, izomeria geometryczna)
Pewien alken A oraz jego izomer konstytucyjny B tworzą różnego typu stereoizomery. Pierwszy z nich występuje wyłącznie w postaci pary enancjomerów, natomiast drugi jako para izomerów geometrycznych. Addycja wodoru w obecności katalizatora niklowego do związków A i B daje ten sam nieczynny optycznie produkt C. Związki chemiczne A i B są najlżejszymi alkenami spełniającymi opisane warunki.
Narysuj wzór półstrukturalny i podaj nazwę systematyczną związku chemicznego C. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń dotyczących doświadczenia z udziałem nadtlenku wodoru oraz azotanu(III) sodu
W probówce umieszczono wodny roztwór azotanu(III) sodu z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. Do układu wprowadzono następnie stechiometryczną ilość wody utlenionej i zaobserwowano zmianę świadczącą o przebiegu reakcji chemicznej.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Wodny roztwór azotanu(III) sodu miał odczyn (kwasowy/obojętny/zasadowy). Rolę reduktora w opisanym procesie redoks pełniły wówczas jony (OH–/NO2–), natomiast utleniaczem były cząsteczki (H2O2/H2O). W wyniku przebiegu reakcji chemicznej roztwór (zabarwił się/odbarwił się), co pozwala wnioskować, że wartość jego pH uległa (zwiększeniu/zmniejszeniu). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzorów grupowych związków chemicznych biorących udział w ciągu syntez organicznych
W celu otrzymania pewnej halogenopochodnej etylobenzenu, zawierającej 40,57% wagowych halogenu przeprowadzono cykl kilku reakcji chemicznych:
Cząsteczki związku chemicznego A występują w postaci dwóch rodzajów cyklicznych konformerów, w których wszystkim atomom węgla przypisuje się stopień utlenienia równy -II. Węglowodory A i B mają taką samą liczbę atomów węgla w cząsteczce.
Wykonaj stosowne obliczenia i ustal wzory grupowe cząsteczek organicznych związków chemicznych A÷D, które brały udział w opisanym cyklu syntez. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie typu reakcji oraz mechanizmu z jakim przebiegają na podstawie schematu ciągu przemian chemicznych
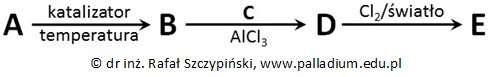
W celu otrzymania pewnej halogenopochodnej etylobenzenu, zawierającej 40,57% wagowych halogenu przeprowadzono cykl kilku reakcji chemicznych:

Cząsteczki związku chemicznego A występują w postaci dwóch rodzajów cyklicznych konformerów, w których wszystkim atomom węgla przypisuje się stopień utlenienia równy -II. Węglowodory A i B mają taką samą liczbę atomów węgla w cząsteczce.
Określ, typy reakcji (addycja, substytucja, eliminacja) oraz mechanizmy (elektrofilowy, nukleofilowy, rodnikowy) zgodnie z którymi przebiegają reakcje B → D oraz D → E oznaczone na schemacie. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone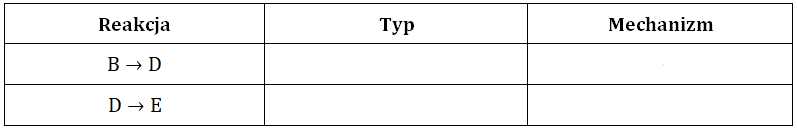
Rysowanie wzoru grupowego dichloropochodnej benzenu spełniającej określone warunki
W wyniku monochlorowania chlorobenzenu w obecności katalizatora powstała mieszanina dichloropochodnych benzenu, przy czym w uzyskanym układzie wykryto jedynie śladowe ilości jednego z izomerów, stanowiącego produkt uboczny (nieuprzywilejowany) opisanej reakcji.
Wiedząc, że izomeryczne związki chemiczne o budowie polarnej mają wyższe temperatury wrzenia, niż substancje, których cząsteczki nie są dipolami elektrycznymi, narysuj wzór grupowy tej spośród powstałych dichloropochodnych, która jest jednocześnie uprzywilejowanym produktem opisanej reakcji chlorowania oraz ma najniższą temperaturę wrzenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie nazwy nieuprzywilejowanego produktu chlorowania chlorobenzenu z wyjaśnieniem
W wyniku monochlorowania chlorobenzenu w obecności katalizatora powstała mieszanina dichloropochodnych benzenu, przy czym w uzyskanym układzie wykryto jedynie śladowe ilości jednego z izomerów, stanowiącego produkt uboczny (nieuprzywilejowany) opisanej reakcji.
Podaj nazwę systematyczną nieuprzywilejowanej dichloropochodnej powstałej podczas opisanej reakcji chlorowania, a następnie wyjaśnij, dlaczego nie jest to produkt główny? Nazwa systematyczna: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazwy pierwiastka oraz konfiguracji elektronowej jego rdzenia atomowego
Liczba protonów pewnego pierwiastka chemicznego X stanowi wartość będącą różnicą między sumą oraz różnicą wartości liczb atomowych złota oraz argonu.
Podaj nazwę pierwiastka chemicznego X, a następnie stosując symbole podpowłok zapisz konfigurację elektronową jego rdzenia atomowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie symboli pierwiastków chemicznych do schematów fragmentów konfiguracji klatkowych w stanie podstawowym lub wzbudzonym
Podczas wzbudzania elektronu następuje jego przeniesienie na wyższy poziom energetyczny. Rysunki poniżej przedstawiają schematy fragmentów klatkowych konfiguracji elektronowych kilku pierwiastków chemicznych w stanie podstawowym lub wzbudzonym.
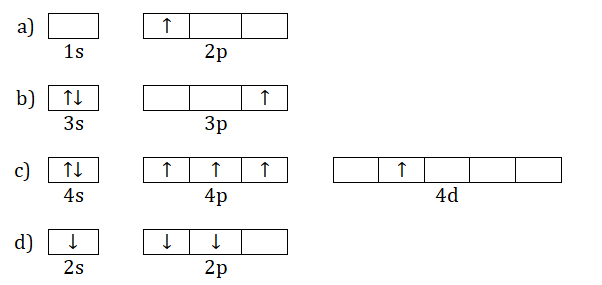
Przypisz oznaczenia literowe (a÷d) nazwom lub symbolom tych pierwiastków chemicznych, których stany wzbudzone zilustrowano na widocznych schematach klatkowych. Jeśli któraś spośród wymienionych konfiguracji elektronowych dotyczy stanu podstawowego, wpisz „–”. a) b) c) d) © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego pierwiastka oraz określenie sumarycznej wartości pobocznych liczb kwantowych jego elektronów niesparowanych
Podczas wzbudzania elektronu następuje jego przeniesienie na wyższy poziom energetyczny. Rysunki poniżej przedstawiają schematy fragmentów klatkowych konfiguracji elektronowych kilku pierwiastków chemicznych w stanie podstawowym lub wzbudzonym.

Napisz oznaczenie (a÷d) tego pierwiastka chemicznego, który ma największą liczbę elektronów walencyjnych wśród wymienionych pierwiastków, a następnie określ sumaryczną wartość pobocznych liczb kwantowych opisujących jego wszystkie elektrony niesparowane w przedstawionym schemacie klatkowym konfiguracji elektronowej. Pierwiastek: Sumaryczna wartość pobocznych liczb kwantowych: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

