Ustalanie odczynu wodnego roztworu na podstawie danych ilościowych substratów
Zmieszano wodny roztwór zawierający 15 g kwasu azotowego(V) z wodnym roztworem zawierającym 10 g wodorotlenku sodu.
Ustal odczyn uzyskanej mieszaniny. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalenie, który z substratów został użyty w nadmiarze oraz masy tego nadmiaru
W tyglu porcelanowym umieszczono 1,68 g żelaza oraz 1,28 g siarki. W wyniku przebiegu ze 100% wydajnością reakcji chemicznej powstało 2,64 g FeS.
Ustal, który z substratów został użyty w nadmiarze oraz określ, jaki był to nadmiar. Wynik obliczeń wyraź w miligramach. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości powstałego wodoru w reakcji cynku z roztworem kwasu siarkowego(VI)
Do wodnego roztworu kwasu siarkowego(VI) zawierającego 4,9 g kwasu wrzucono 3,9 g cynku, co poskutkowało przebiegiem reakcji chemicznej:
Zn + H2SO4 → ZnSO4 + H2
Ile centymetrów sześciennych zajmie w warunkach normalnych powstały wodór? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stosunku wagowego substratów w reakcji syntezy siarczku magnezu z udziałem nadmiaru reagenta
Siarczek magnezu (MgS) można otrzymać ogrzewając siarkę z magnezem.
Oblicz, w jakim stosunku wagowym należy zmieszać magnez i siarkę, aby po zakończeniu biegnącej ze 100% wydajnością reakcji chemicznej mieszanina poreakcyjna zawierała siarczek magnezu oraz magnez w stosunku molowym 2:3? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
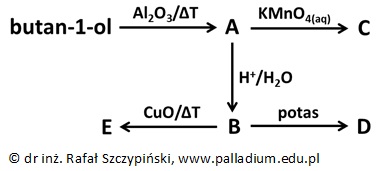
Wybór odpowiedniego wskaźnika kwasowo-zasadowego, który barwi się na ten sam kolor w dwóch z opisanych roztworów
W tabeli zamieszczono dane na temat wybranych wskaźników kwasowo-zasadowych:
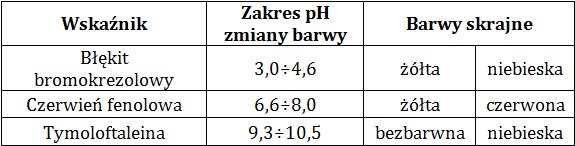
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W trzech probówkach umieszczono kolejno po 5 cm3 wodnych roztworów związków chemicznych o stężeniach:
Ba(OH)2 2·10–4 mol·dm–3, HClO2 2·10–2 mol·dm–3 oraz HClO 2·10–4 mol·dm–3.
W roztworach: wodorotlenku baru i kwasu chlorowego(I) o podanych stężeniach molowych jeden z wymienionych wskaźników kwasowo-zasadowych barwi się na ten sam kolor.
Podaj nazwę tego wskaźnika oraz barwę obu wymienionych roztworów w opisanych warunkach. Swój wybór uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy wody uzyskanej w wyniku reakcji zainicjowanej po zmieszaniu wodoru z powietrzem
Zmieszano wodór oraz powietrze w stosunku objętościowym 2:1 i zainicjowano reakcję chemiczną.
Oblicz, ile miligramów wody uzyskano przy założeniu 100% wydajności procesu, jeśli całkowita objętość użytej mieszaniny gazów w temperaturze 20 oC pod ciśnieniem 1010 hPa wynosiła 210 cm3. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zawartości procentowej siarczku cynku w mieszaninie poreakcyjnej
Zmieszano 1,6 g siarki z nieznaną ilością cynku i zainicjowano reakcję chemiczną, która przebiegła ze 100% wydajnością. Ustalono, że mieszanina poreakcyjna zawierała 1 g nieprzereagowanego metalu.
Na podstawie niezbędnych obliczeń ustal zawartość procentową (procenty wagowe) siarczku cynku w mieszaninie poreakcyjnej, jeśli wiadomo, że nie była ona zanieczyszczona siarką. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie najsilniejszego utleniacza oraz najsilniejszego reduktora w zbiorze pierwiastków chemicznych
Pod literami A÷E kryją się symbole pięciu pierwiastków chemicznych. Wiadomo, że pierwiastek A ma trzy powłoki elektronowe i tworzy dwuujemne jony proste. Drobina powstała w wyniku przyłączenia jednego elektronu do pierwiastka B jest izoelektronowa z atomem argonu. W skróconej konfiguracji elektronowej pierwiastka C jest w sumie 16 elektronów opisanych orbitalami s, p i d, a jego masa atomowa jest mniejsza od masy atomowej kryptonu. Pierwiastek D ma największe powinowactwo elektronowe spośród wszystkich znanych nam pierwiastków. Pierwiastek E jest niemetalem, a jego atomy mają o jedną powłokę elektronową więcej niż atomy pierwiastka C i (w stanie podstawowym) parzystą liczbę elektronów niesparowanych.
Który spośród pierwiastków A÷E jest najsilniejszym utleniaczem, a który z nich najsilniejszym reduktorem? Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy powstałego żelaza na podstawie masy produktu uzyskanego we współbieżnym procesie redukcji magnetytu
W pewnych warunkach reakcja redukcji magnetytu wodorem przebiega zgodnie z równaniem stechiometrycznym:
Fe3O4 + 4H2 → 3Fe + 4H2O
Podczas redukcji tlenku Fe3O4 wodorem może również przebiegać równolegle proces, którego produktem zamiast żelaza jest inny tlenek tego metalu (FeO) oraz woda. W wyniku redukcji 11,6 g magnetytu nadmiarem wodoru powstało 4,32 g tlenku żelaza(II).
Wiedząc, że w opisanych warunkach powstały tlenek żelaza(II) nie ulega dalszej redukcji, oblicz, jaką masę metalicznego żelaza uzyskano w tym doświadczeniu? Wynik podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka chemicznego oraz konfiguracji elektronowej na podstawie opisu jego elektronów walencyjnych
W stanie podstawowym w atomach pewnego pierwiastka X elektrony walencyjne opisane orbitalami 3d stanowią dokładnie 60% jego wszystkich elektronów walencyjnych.
Podaj symbol pierwiastka X oraz jego pełną konfigurację elektronową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone