Zapis równań reakcji chemicznych wodorku niemetalu, którego wzór trzeba odszyfrować
Cząsteczki pewnego wodorku niemetalu mają budowę kątową i zawierają 5,88% wodoru. W każdej z nich są dwie niewiążące pary elektronowe, a jeden z izotopów atomu centralnego zawiera tyle samo nukleonów, co atom germanu dodatnich ładunków jądra.
Przeprowadzono dwa doświadczenia chemiczne z wykorzystaniem opisanego wodorku.
Doświadczenie nr 1: wodorek wprowadzono do wody wapiennej, w wyniku czego powstała sól obojętna.
Doświadczenie nr 2: wodorek spalono w niewielkim nadmiarze tlenu, a gazowym produktem reakcji nasycono wodę zawierającą lakmus.
Napisz równania dwóch pierwszych z opisanych reakcji chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozszyfrowanie wzoru wodorku oraz uzasadnienie odczynu roztworu powstałego z udziałem produktu spalania
Cząsteczki pewnego wodorku niemetalu mają budowę kątową i zawierają 5,88% wodoru. W każdej z nich są dwie niewiążące pary elektronowe, a jeden z izotopów atomu centralnego zawiera tyle samo nukleonów, co atom germanu dodatnich ładunków jądra.
Przeprowadzono dwa doświadczenia chemiczne z wykorzystaniem opisanego wodorku.
Doświadczenie nr 1: wodorek wprowadzono do wody wapiennej, w wyniku czego powstała sól obojętna.
Doświadczenie nr 2: wodorek spalono w niewielkim nadmiarze tlenu, a gazowym produktem reakcji nasycono wodę zawierającą lakmus.
Określ, jakie zabarwienie miał roztwór po zakończeniu doświadczenia nr 2? Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru sumarycznego kwasowego wodorku na podstawie wartości gęstości względnej
Wodę dejonizowaną z dodatkiem fenoloftaleiny nasycono 1,12 dm3 amoniaku. Przez uzyskany roztwór wody amoniakalnej przepuszczono 560 cm3 kwasowego wodorku, którego gęstość par względem chloru wynosi 1,83. Objętości gazów odmierzono w tych samych warunkach ciśnienia i temperatury.
Na podstawie niezbędnych obliczeń ustal wzór sumaryczny opisanego kwasowego wodorku. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej wody amoniakalnej z określoną ilością nieznanego wodorku niemetalu
Wodę dejonizowaną z dodatkiem fenoloftaleiny nasycono 1,12 dm3 amoniaku. Przez uzyskany roztwór wody amoniakalnej przepuszczono 560 cm3 kwasowego wodorku, którego gęstość par względem chloru wynosi 1,83. Objętości gazów odmierzono w tych samych warunkach ciśnienia i temperatury.
Napisz równanie reakcji chemicznej kwasowego wodorku z wodą amoniakalną, jeśli zastosowano ilości reagentów opisane w informacji wprowadzającej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń dotyczących doświadczenia z udziałem wody amoniakalnej oraz wodorku niemetalu, którego wzór trzeba odszyfrować
Wodę dejonizowaną z dodatkiem fenoloftaleiny nasycono 1,12 dm3 amoniaku. Przez uzyskany roztwór wody amoniakalnej przepuszczono 560 cm3 kwasowego wodorku, którego gęstość par względem chloru wynosi 1,83. Objętości gazów odmierzono w tych samych warunkach ciśnienia i temperatury.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Wobec fenoloftaleiny woda amoniakalna barwi się na kolor (żółty/różowy/zielony). Po przepuszczeniu przez roztwór podanej ilości kwasowego wodorku, zawartość naczynia reakcyjnego (uległa/nie uległa) odbarwieniu. Po całkowitym odparowaniu rozpuszczalnika otrzymano związek chemiczny, który jest (gazem/cieczą/ciałem stałym) o budowie (kowalencyjnej/jonowej). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór probówek, w których zaobserwowano zmiany w wyniku reakcji wodorku niemetalu, którego wzór trzeba odszyfrować
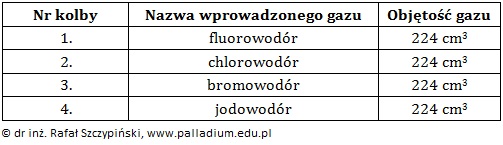
O dwóch kwasowych wodorkach niemetali wiadomo, że w tych samych warunkach gęstość ich par względem metanu wynosi 5,06. Masa molowa niemetalu w wodorku X jest mniejsza od masy molowej niemetalu w wodorku Y.
Przeprowadzono doświadczenie, którego schemat opisano poniższym rysunkiem:
W probówce oznaczonej cyfrą 1 znajdowała się wodna zawiesina tlenku glinu. Zawartość probówek oznaczonych kolejno cyframi 2 i 3 stanowiły rozcieńczone roztwory wodne. Do każdej z probówek dodano stechiometryczną ilość rozcieńczonego wodnego roztworu wodorku Y. Podczas doświadczenia zawartość naczyń poddano wyłącznie ocenie wzrokowej.
Opisz, w których probówkach odnotowano zmiany świadczące o przebiegu reakcji chemicznej? Uzasadnij swoje stanowisko, zapisując w formie jonowej skróconej równania odpowiednich reakcji chemicznych – po jednym dla każdej z wybranych przez Ciebie probówek. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji dotyczących doświadczenia z wykorzystaniem roztworów zasady sodowej oraz chlorku magnezu
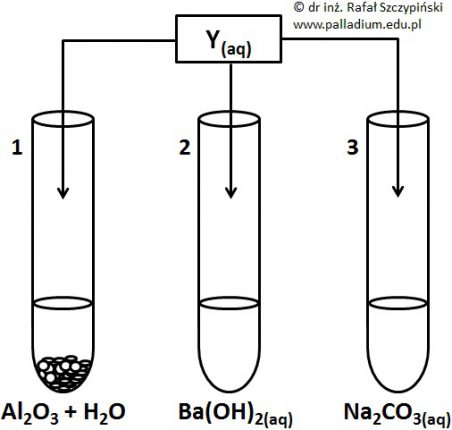
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek:
Podczas opisanego doświadczenia do probówek oznaczonych cyframi 1 oraz 3 wprowadzono nadmiar (względem substancji rozpuszczonej) odczynnika i energicznie wstrząśnięto ich zawartością. W jednym z naczyń uzyskano roztwór rzeczywisty.
Napisz, co zaobserwowano w pierwszej probówce w wyniku przeprowadzonego doświadczenia? Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Obserwacje: Równanie reakcji chemicznej: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie jak zmieniła się barwa fazy wodnej w wyniku przeprowadzonego doświadczenia z udziałem wodorotlenku wapnia
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek:

Podczas opisanego doświadczenia do probówek oznaczonych cyframi 1 oraz 3 wprowadzono nadmiar (względem substancji rozpuszczonej) odczynnika i energicznie wstrząśnięto ich zawartością. W jednym z naczyń uzyskano roztwór rzeczywisty. W wyniku przeprowadzonego eksperymentu z udziałem zawartości probówki nr 2 zaobserwowano zmianę barwy fazy wodnej.
Napisz, na czym ta zmiana polegała? Odpowiedź uzasadnij równaniem chemicznym odpowiedniego procesu oraz podaj jego nazwę. Odpowiedź: Równanie chemiczne procesu: Nazwa procesu: Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis obserwacji podczas przebiegu doświadczenia z udziałem tlenku azotu(V)
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek:

Podczas opisanego doświadczenia do probówek oznaczonych cyframi 1 oraz 3 wprowadzono nadmiar (względem substancji rozpuszczonej) odczynnika i energicznie wstrząśnięto ich zawartością. W jednym z naczyń uzyskano roztwór rzeczywisty.
Napisz, co zaobserwowano w probówce oznaczonej cyfrą 3 podczas przeprowadzenia eksperymentu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone