Zapis równania procesu decydującego o odczynie roztworu w teorii Brønsteda. Zadanie 15.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
W czterech zlewkach znajdowały się – w losowej kolejności – bezbarwne wodne roztwory różnych soli: węglanu sodu, azotanu(V) ołowiu(II), jodku potasu i siarczanu(VI) cynku. W każdej zlewce był roztwór innej soli. Roztwory tych soli oznaczono numerami I–IV. W celu identyfikacji zawartości każdej zlewki przeprowadzono dwuetapowe doświadczenie.
Etap 1. Roztwór I wprowadzono do trzech probówek, a następnie do każdej z nich dodano po około 2 cm3 roztworu II, III i IV. Analogicznie postąpiono z pozostałymi roztworami:
– do roztworu II dodano roztwory I, III i IV,
– do roztworu III dodano roztwory I, II i IV,
– do roztworu IV dodano roztwory I, II i III. Wyniki doświadczenia przedstawiono w tabeli.

Etap 2. Niewielkie objętości roztworów I–IV przelano do czterech probówek i zbadano ich odczyn przy użyciu alkoholowego roztworu błękitu bromotymolowego. Poniżej przedstawiono wyniki przeprowadzonego doświadczenia.

Napisz równanie reakcji decydującej o odczynie roztworu IV. Wpisz do schematu wzory odpowiednich drobin. Zastosuj definicję kwasu i zasady Brønsteda.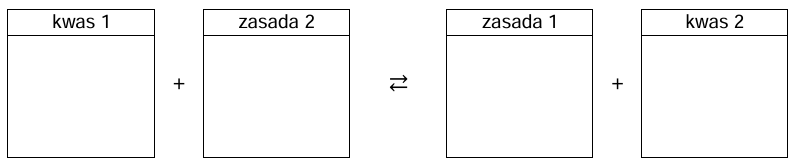
Obliczanie masy płytki po zakończeniu doświadczenia. Zadanie 16.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Poniższe równanie opisuje reakcję kationów miedzi(II) z metalicznym niklem.
Cu2+(aq) + Ni (s) → Ni2+(aq) + Cu (s)
Ta przemiana może zachodzić w różnych układach, np.:
– w roztworze soli miedzi(II) po zanurzeniu w nim blaszki niklowej,
– w ogniwie złożonym z odpowiednich półogniw metalicznych.
Przygotowano wodny roztwór CuSO4 o stężeniu 0,50 mol∙dm–3 i objętości 20,0 cm3. W tym roztworze zanurzono niklową płytkę o masie 5,820 g. Po pewnym czasie płytkę wyjęto i osuszono. Stwierdzono, że:
– po zakończeniu doświadczenia stężenie jonów Cu2+ w roztworze wynosiło 0,040 mol∙dm–3,
– w warunkach doświadczenia cały wydzielony metal osadził się na płytce.
Oblicz masę płytki po wyjęciu jej z roztworu i osuszeniu. Załóż, że objętość roztworu nie uległa zmianie. W obliczeniach przyjmij następujące wartości mas molowych: MCu = 63,55 g∙mol–1 i MNi = 58,69 g∙mol–1.
Ocena poprawności zdań dotyczących ogniwa chemicznego. Zadanie 16.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Poniższe równanie opisuje reakcję kationów miedzi(II) z metalicznym niklem.
Cu2+(aq) + Ni (s) → Ni2+(aq) + Cu (s)
Ta przemiana może zachodzić w różnych układach, np.:
– w roztworze soli miedzi(II) po zanurzeniu w nim blaszki niklowej,
– w ogniwie złożonym z odpowiednich półogniw metalicznych.
Skonstruowano ogniwo elektrochemiczne złożone ze standardowego półogniwa miedziowego oraz standardowego półogniwa niklowego. Półogniwa połączono kluczem elektrolitycznym w formie U-rurki wypełnionej nasyconym roztworem azotanu(V) potasu.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Siła elektromotoryczna opisanego ogniwa w warunkach standardowych jest równa 0,216 V. 2. W trakcie pracy opisanego ogniwa kationy potasu przemieszczają się z klucza elektrolitycznego w kierunku półogniwa miedziowego, a aniony azotanowe(V) – w kierunku półogniwa niklowego.
Wskazanie z uzasadnieniem półogniwa o wyższym potencjale redukcji. Zadanie 17. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Roztwarzanie tlenków wanadu (VO, V2O3, VO2, V2O5) w kwasach nie zawsze prowadzi do powstania prostych kationów wanadu, takich jak V2+ lub V3+, gdyż ten pierwiastek na wyższych stopniach utlenienia tworzy jony oksowanadowe, takie jak VO2+ lub VO2+. Po zmieszaniu roztworu zawierającego kationy VO2+ z roztworem zawierającym kationy V2+ w środowisku kwasowym zachodzi reakcja, którą można opisać równaniem:
VO2+ (aq) + V2+ (aq) + 2H3O+ (aq) → VO2+ (aq) + V3+ (aq) + 3H2O (c)
Na podstawie: C. Blanc, A. Rufer, Paths to Sustainable Energy, Lozanna 2010.
W poniższej tabeli podano równania dwóch reakcji:
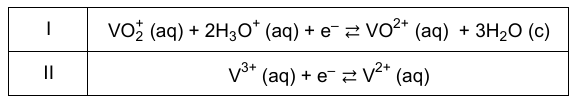
Rozstrzygnij, która reakcja – I czy II – charakteryzuje się wyższą wartością standardowego potencjału redukcji. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Zapis nazwy systematycznej węglowodoru na podstawie rysunku modelu jego cząsteczki. Zadanie 18.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Poniżej przedstawiono model przestrzenny cząsteczki pewnego węglowodoru X.
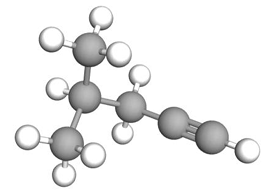
Napisz nazwę systematyczną węglowodoru X.
Wskazanie liczby atomów węgla o hybrydyzacji sp3 oraz liczby wiązań pi w cząsteczce węglowodoru. Zadanie 18.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Poniżej przedstawiono model przestrzenny cząsteczki pewnego węglowodoru X.

Uzupełnij tabelę. Wpisz liczbę atomów węgla o hybrydyzacji orbitali walencyjnych typu sp3 oraz liczbę wiązań typu 𝝅 w cząsteczce węglowodoru X.
Wskazanie chiralnych izomerów węglowodoru. Zadanie 18.3. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Poniżej przedstawiono model przestrzenny cząsteczki pewnego węglowodoru X.

Spośród poniżej przedstawionych modeli zaznacz wszystkie te, które przedstawiają izomery węglowodoru X i których cząsteczki są chiralne.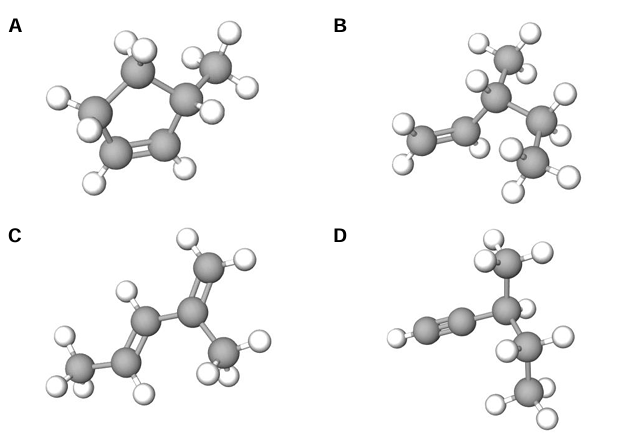
Zapis równania reakcji biegnącej w I etapie doświadczenia. Zadanie 19. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Przeprowadzono trzyetapowe doświadczenie.
Etap 1. W probówce zmieszano bezbarwne wodne roztwory bromianu(V) potasu oraz bromku potasu. Następnie do mieszaniny dodano kilka kropli kwasu siarkowego(VI). Na zdjęciu przedstawiono wynik tego etapu doświadczenia:

Etap 2. Do mieszaniny otrzymanej w etapie 1. wprowadzono toluen – metylobenzen – (d = 0,86 g∙cm−3). Probówkę zamknięto korkiem, a następnie ciecze wymieszano. Na zdjęciach przedstawiono wygląd zawartości probówki przed wymieszaniem oraz po wymieszaniu:

Etap 3. Otrzymaną w etapie 2. mieszaninę pozostawiono na pewien czas w nasłonecznionym miejscu. Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas etapu 1. przeprowadzonego doświadczenia.
Formułowanie wniosku na podstawie II etapu doświadczenia oraz wskazanie nazwy procesu. Zadanie 20. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Przeprowadzono trzyetapowe doświadczenie.
Etap 1. W probówce zmieszano bezbarwne wodne roztwory bromianu(V) potasu oraz bromku potasu. Następnie do mieszaniny dodano kilka kropli kwasu siarkowego(VI). Na zdjęciu przedstawiono wynik tego etapu doświadczenia:

Etap 2. Do mieszaniny otrzymanej w etapie 1. wprowadzono toluen – metylobenzen – (d = 0,86 g∙cm−3). Probówkę zamknięto korkiem, a następnie ciecze wymieszano. Na zdjęciach przedstawiono wygląd zawartości probówki przed wymieszaniem oraz po wymieszaniu:

Etap 3. Otrzymaną w etapie 2. mieszaninę pozostawiono na pewien czas w nasłonecznionym miejscu. Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Sformułuj wniosek wynikający z etapu 2. przeprowadzonego doświadczenia. Uwzględnij w nim rozpuszczalność w wodzie i w toluenie barwnej substancji otrzymanej w etapie 1. tego doświadczenia. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy. Wniosek: Nazwa procesu:
Zapis równania reakcji biegnącej w III etapie doświadczenia. Zadanie 21. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Przeprowadzono trzyetapowe doświadczenie.
Etap 1. W probówce zmieszano bezbarwne wodne roztwory bromianu(V) potasu oraz bromku potasu. Następnie do mieszaniny dodano kilka kropli kwasu siarkowego(VI). Na zdjęciu przedstawiono wynik tego etapu doświadczenia:

Etap 2. Do mieszaniny otrzymanej w etapie 1. wprowadzono toluen – metylobenzen – (d = 0,86 g∙cm−3). Probówkę zamknięto korkiem, a następnie ciecze wymieszano. Na zdjęciach przedstawiono wygląd zawartości probówki przed wymieszaniem oraz po wymieszaniu:

Etap 3. Otrzymaną w etapie 2. mieszaninę pozostawiono na pewien czas w nasłonecznionym miejscu. Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Napisz równanie reakcji, która zaszła podczas etapu 3. przeprowadzonego doświadczenia, jeśli stosunek molowy reagentów wynosi 1:1. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Uzupełnienie schematu otrzymywania poliizobutylenu. Zadanie 22. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Związek chemiczny o nazwie 2-metyloprop-1-en (izobutylen) jest ważnym surowcem w syntezach organicznych. Przeprowadzono dwie reakcje z udziałem 2-metyloprop-1-enu jako substratu. W reakcji I ten związek poddano polimeryzacji i otrzymano poliizobutylen. W reakcji II przeprowadzono addycję bromowodoru do 2-metyloprop-1-enu.
Uzupełnij schemat tak, aby przedstawiał równanie reakcji otrzymywani poliizobutylenu.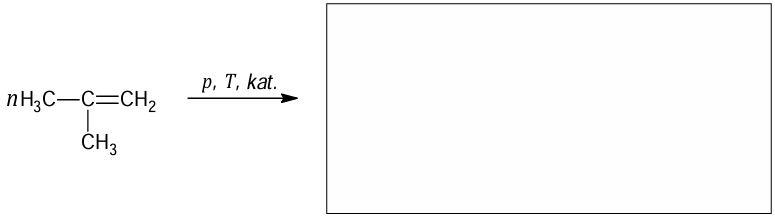
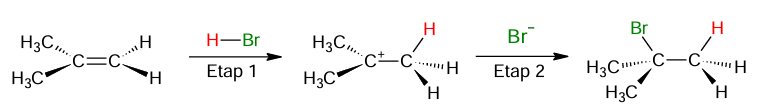
Ocena poprawności zdań dotyczących reakcji addycji bromowodoru do 2-metyloprop-1-enu. Zadanie 23.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Związek chemiczny o nazwie 2-metyloprop-1-en (izobutylen) jest ważnym surowcem w syntezach organicznych. Przeprowadzono dwie reakcje z udziałem 2-metyloprop-1-enu jako substratu. W reakcji I ten związek poddano polimeryzacji i otrzymano poliizobutylen. W reakcji II przeprowadzono addycję bromowodoru do 2-metyloprop-1-enu.
Addycja bromowodoru do 2-metyloprop-1-enu zachodzi zgodnie z dwuetapowym mechanizmem ukazanym na poniższym schemacie.
Na wykresie przedstawiono zmianę energii potencjalnej drobin podczas przebiegu reakcji chemicznej.
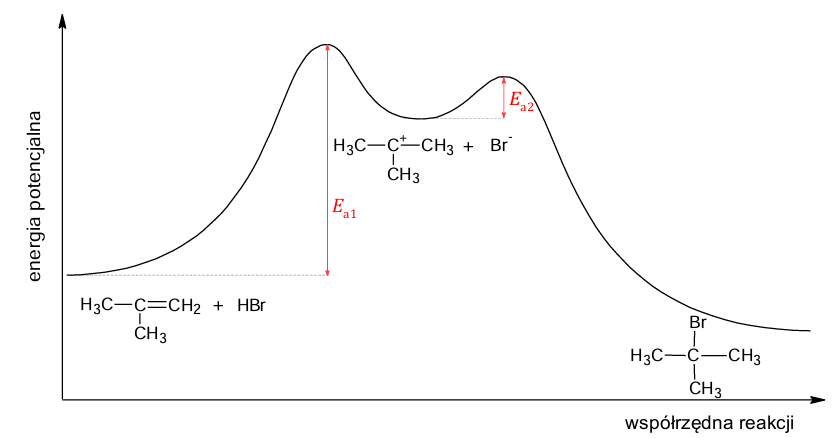
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Entalpia reakcji addycji bromowodoru do 2-metyloprop-1-enu przyjmuje wartość ujemną (ΔH < 0). 2. Reakcja addycji bromowodoru do 2-metyloprop-1-enu zachodzi zgodnie z mechanizmem nukleofilowym.
Wskazanie z uzasadnieniem wolniejszego etapu reakcji. Zadanie 23.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Związek chemiczny o nazwie 2-metyloprop-1-en (izobutylen) jest ważnym surowcem w syntezach organicznych. Przeprowadzono dwie reakcje z udziałem 2-metyloprop-1-enu jako substratu. W reakcji I ten związek poddano polimeryzacji i otrzymano poliizobutylen. W reakcji II przeprowadzono addycję bromowodoru do 2-metyloprop-1-enu.
Addycja bromowodoru do 2-metyloprop-1-enu zachodzi zgodnie z dwuetapowym mechanizmem ukazanym na poniższym schemacie.

Na wykresie przedstawiono zmianę energii potencjalnej drobin podczas przebiegu reakcji chemicznej.

Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Szybkość reakcji chemicznej zależy od szybkości najwolniejszego etapu danej przemiany.
Rozstrzygnij, który etap – 1 czy 2 – jest wolniejszy, więc decyduje o szybkości reakcji addycji bromowodoru do 2-metyloprop-1-enu. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Wybór właściwych określeń dotyczących acetonu. Zadanie 24. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Propan-2-on (aceton) to powszechnie stosowany rozpuszczalnik organiczny, który miesza się z wodą bez ograniczeń. Propan-2-on można otrzymać m.in.:
1. w wyniku addycji wody do odpowiedniego węglowodoru w środowisku kwasowym i w obecności jonów Hg2+.
2. Podczas utleniania odpowiedniego alkoholu.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Uzupełnij poniższe zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. W ciekłym propanonie najsilniejszymi oddziaływaniami międzycząsteczkowymi są (wiązania wodorowe / oddziaływania dipolowe). W wodnym roztworze propanonu pomiędzy cząsteczkami tego związku a cząsteczkami wody (tworzą / nie tworzą) się wiązania wodorowe.
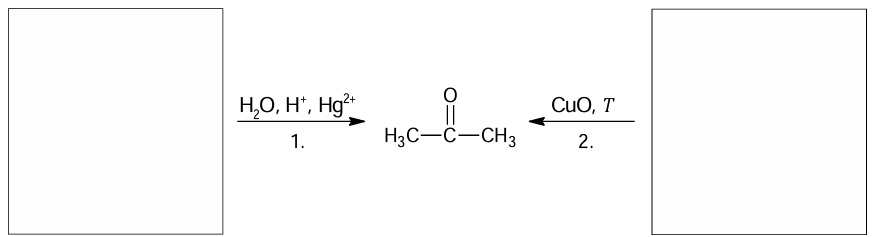
Uzupełnienie schematu organicznymi substratami reakcji otrzymywania acetonu. Zadanie 25. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Propan-2-on (aceton) to powszechnie stosowany rozpuszczalnik organiczny, który miesza się z wodą bez ograniczeń. Propan-2-on można otrzymać m.in.:
1. w wyniku addycji wody do odpowiedniego węglowodoru w środowisku kwasowym i w obecności jonów Hg2+.
2. Podczas utleniania odpowiedniego alkoholu.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Uzupełnij poniższy schemat. Napisz wzory półstrukturalne (grupowe) organicznych substratów opisanych reakcji otrzymywania propanonu.