Określanie odczynu roztworu w punkcie równoważnikowym miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 8
Zmiareczkowano 400 cm3 wodnego roztworu wodorotlenku wapnia wobec fenoloftaleiny. Punkt równoważnikowy osiągnięto po wprowadzeniu 20 cm3 roztworu titranta, którym był roztwór kwasu solnego o stężeniu 0,2 mol∙dm–3.
Oceń, czy wartość pH roztworu w punkcie równoważnikowym miareczkowania byłaby większa, mniejsza, czy równa 7, gdyby zamiast miareczkowanego roztworu wodorotlenku wapnia użyto roztwór kwasu mrówkowego, a titrantem był wówczas wodny roztwór wodorotlenku potasu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie charakteru chemicznego tlenku niklu(II) na podstawie przeprowadzonego eksperymentu. Podręcznik 7.2 zad. 1
W celu ustalenia charakteru chemicznego tlenku niklu(II) wykonano pewne doświadczenie chemiczne. W trzech probówkach umieszczono próbki opisanego związku chemicznego, a następnie do każdej z nich wprowadzono niewielki nadmiar wody (probówka nr 1) oraz wodnych roztworów – wodorotlenku potasu (probówka nr 2) i kwasu siarkowego(VI) (probówka nr 3). Zawartością każdego z naczyń reakcyjnych energicznie wstrząśnięto. W pierwszych dwóch probówkach nie zaobserwowano zmian świadczących o przebiegu reakcji chemicznej, podczas gdy w trzeciej probówce ciało stałe uległo roztworzeniu.
Określ charakter chemiczny tlenku wykorzystanego podczas tego doświadczenia. Odpowiedź uzasadnij zapisując równania odpowiednich reakcji chemicznych w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem tlenku siarki(VI). Podręcznik 7.2 zad. 2
Przeprowadzono pewne doświadczenie chemiczne z wykorzystaniem tlenku siarki(VI). Związek ten wprowadzono w nadmiarze do dwóch różnych probówek, zawierających po trzy krople oranżu metylowego oraz:
probówka nr 1: wodę;
probówka nr 2: wodny roztwór wodorotlenku cezu.
Napisz, co zaobserwowano w każdym z naczyń? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie charakteru chemicznego tlenku miedzi(I) na podstawie przeprowadzonego eksperymentu. Podręcznik 7.2 zad. 3
W rezultacie pozytywnego wyniku próby Trommera z udziałem glukozy powstaje ceglastoczerwony osad tlenku miedzi(I), który nie roztwarza się w nadmiarze roztworu zasady sodowej.
Określ, jaki jest charakter chemiczny opisanego tlenku? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie, czy przeprowadzone doświadczenie jest wystarczające, aby określić charakter chemiczny wodorotlenku galu. Podręcznik 7.2 zad. 4
Na świeżo strącony osad wodorotlenku galu podziałano nadmiarem roztworu wodorotlenku potasu. Po wstrząśnięciu zawartością naczynia reakcyjnego stwierdzono, że cały osad uległ roztworzeniu.
Oceń, czy przeprowadzone doświadczenie było wystarczające, aby stwierdzić amfoteryczny charakter tlenku galu? Odpowiedź uzasadnij. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odróżnianie wodnych roztworów siarczanu(VI) cynku oraz siarczanu(VI) magnezu. Podręcznik 7.2 zad. 5
W dwóch nieopisanych probówkach znajdują się wodne roztwory – siarczanu(VI) cynku oraz siarczanu(VI) magnezu.
Zaproponuj doświadczenie, którego celem będzie odróżnienie od siebie zawartości obu naczyń. W tym celu wybierz jeden z podanych odczynników, a następnie opisz tok postępowania, w którym przedstawisz stosowne obserwacje oraz wnioski. Dostępne odczynniki: HCl(aq), KOH(aq), BaCl2(aq), fenoloftaleina. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
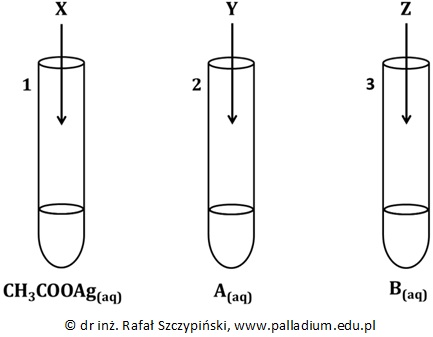
Obserwacje na podstawie przeprowadzonego eksperymentu z udziałem tlenków metali oraz wodorotlenków. Podręcznik 7.2 zad. 6
Rozpuszczalność wodorotlenku potasu w temperaturze 20 ⁰C wynosi 85 g/100 g wody. Przeprowadzono doświadczenie chemiczne, opisane poniższym rysunkiem:
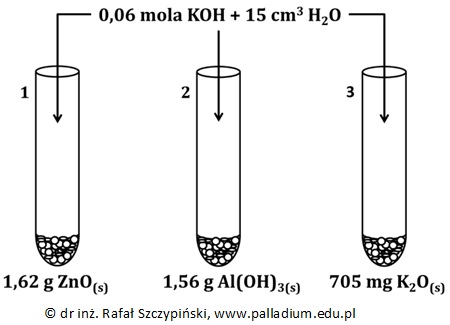
Napisz, co zaobserwowano w każdej z probówek podczas przebiegu tego eksperymentu? Odpowiedź uzasadnij stosownymi obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie równania reakcji redoks oraz wzoru utleniacza i reduktora. Podręcznik 8.1 zad. 1
Poniżej zapisano równania kilku reakcji chemicznych.
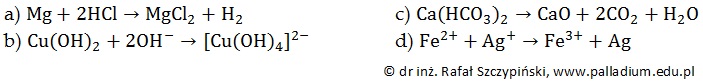
Określ, które z opisanych wyżej przemian należą do reakcji redoks? Następnie wskaż drobinę pełniącą wówczas rolę utleniacza oraz drobinę będącą reduktorem. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie kationu, który w danej parze jest silniejszym utleniaczem. Podręcznik 8.1 zad. 2
Poniżej podano pary kilku wybranych kationów metali.

Korzystając z szeregu napięciowego metali oraz półogniw redoks wskaż (wstawiając znak „<” lub „>”), który jon w danej parze kationów jest silniejszym utleniaczem? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przygotowanie roztworu zawierającego jony Zn2+ o określonym stężeniu molowym (blaszki). Podręcznik 8.2 zad. 5
Cynk jest metalem aktywniejszym od miedzi.
Wykonując stosowne obliczenia oraz dysponując wodą destylowaną, niezbędnym szkłem laboratoryjnym, blaszką cynkową o masie 5 g oraz 80 cm³ wodnego roztworu siarczanu(VI) miedzi(II) o stężeniu 0,25 mol∙dm–3, zaprojektuj doświadczenie, którego celem będzie uzyskanie roztworu o stężeniu jonów Zn2+ równym 0,2 mol∙dm–3. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odróżnianie wodnych roztworów azotanu(V) srebra różniących się stężeniem molowym (blaszki). Podręcznik 8.2 zad. 6
W dwóch nieopisanych kolbach miarowych o pojemności 250 cm3 każda, znajdowały się jednakowe objętości wodnych roztworów azotanu(V) srebra o stężeniach 0,1 mol∙dm–3 oraz 0,5 mol∙dm–3.
Zaproponuj doświadczenie, którego celem będzie odróżnienie zawartości wymienionych naczyń, jeśli dysponujesz identycznymi blaszkami cynkowymi, wagą laboratoryjną, cylindrem miarowym oraz dwiema zlewkami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone