Obliczanie pH roztworu kwasu azotowego(V) po rozcieńczeniu. Zadanie 15. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Do 1,00 dm3 wody destylowanej wprowadzono 90,0 cm3 wodnego roztworu kwasu azotowego(V) o stężeniu 5,00% masowych i gęstości równej 1,03 g·cm–3.
Na podstawie: W. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2015.
Oblicz pH otrzymanego roztworu kwasu azotowego(V). W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworu i wody. Wynik zaokrąglij do drugiego miejsca po przecinku
Ocena poprawności zdań dotyczących doświadczenia z udziałem roztworów - kwasu azotowego(V) oraz KOH. Zadanie 16. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Zmieszano wodny roztwór kwasu azotowego(V) z wodnym roztworem wodorotlenku potasu w stosunku objętościowym VHNO3 : VKOH = 2 : 1. Otrzymano klarowny roztwór o pH = 7.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Stężenie molowe roztworu kwasu azotowego(V) było dwa razy mniejsze niż stężenie molowe roztworu wodorotlenku potasu. 2. Po odparowaniu wody z otrzymanego roztworu pozostanie ciało stałe, w którym stosunek liczby jonów NO3– i K+ 𝑛NO3− : 𝑛K+ = 2 : 1.
Zapis równania reakcji chemicznej zgodnie z teorią Brønsteda. Zadanie 17.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Przygotowano wodne roztwory trzech różnych soli – CH3COONa, NaNO2, NaF – o takim samym stężeniu molowym. Odczyn wszystkich przygotowanych roztworów był zasadowy, ale pH każdego roztworu było inne.
Wpisz do poniższego schematu wzory odpowiednich drobin, tak aby powstało równanie potwierdzające zasadowy odczyn roztworu azotanu(III) sodu – zastosuj definicję kwasu i zasady Brønsteda.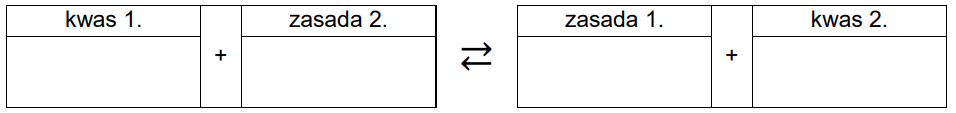
Zapis wzoru soli, której roztwór miał najwyższe pH. Zadanie 17.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Przygotowano wodne roztwory trzech różnych soli – CH3COONa, NaNO2, NaF – o takim samym stężeniu molowym. Odczyn wszystkich przygotowanych roztworów był zasadowy, ale pH każdego roztworu było inne.
Napisz wzór lub nazwę tej soli, której wodny roztwór miał najwyższe pH.
Wskazanie związku chemicznego, którego roztwór poddano miareczkowaniu alkacymetrycznemu. Zadanie 18.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W celu wyznaczenia dokładnego stężenia pewnej zasady przeprowadzono następujące doświadczenie. Do 60,0 cm3 badanego roztworu (KOH albo NH3 o stężeniu około 0,1 mol·dm−3) dodawano powoli wodny roztwór HCl o stężeniu 0,10 mol·dm−3 i mierzono pH mieszaniny reakcyjnej. Otrzymaną zależność pH roztworu miareczkowanego od objętości dodanego kwasu przedstawiono na poniższym wykresie.
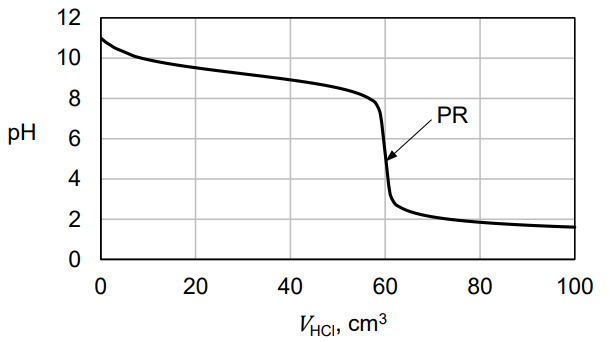
Po dodaniu takiej objętości roztworu HCl, w jakiej ilość kwasu jest równoważna początkowej ilości zasady w badanym roztworze, w układzie zostaje osiągnięty punkt równoważnikowy (PR).
Rozstrzygnij, czy w opisanym doświadczeniu użyto roztworu KOH czy NH3. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Wybór właściwego wskaźnika alkacymetrycznego wraz z uzasadnieniem. Zadanie 18.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W celu wyznaczenia dokładnego stężenia pewnej zasady przeprowadzono następujące doświadczenie. Do 60,0 cm3 badanego roztworu (KOH albo NH3 o stężeniu około 0,1 mol·dm−3) dodawano powoli wodny roztwór HCl o stężeniu 0,10 mol·dm−3 i mierzono pH mieszaniny reakcyjnej. Otrzymaną zależność pH roztworu miareczkowanego od objętości dodanego kwasu przedstawiono na poniższym wykresie.

Po dodaniu takiej objętości roztworu HCl, w jakiej ilość kwasu jest równoważna początkowej ilości zasady w badanym roztworze, w układzie zostaje osiągnięty punkt równoważnikowy (PR).
Aby wyznaczyć stężenie zasady, zamiast pomiaru pH, podczas miareczkowania można zastosować odpowiedni wskaźnik. Musi on być tak dobrany, aby zakres zmiany jego barwy przypadał w pobliżu punktu równoważnikowego. Fenoloftaleina jest wskaźnikiem, który zmienia barwę w zakresie pH 8,2 – 10,0, a oranż metylowy – w zakresie pH 3,2 – 4,4.
Na podstawie: T. Mizerski, Tablice chemiczne, Adamantan 1997.
Rozstrzygnij, który wskaźnik – fenoloftaleina czy oranż metylowy – powinien być użyty w celu możliwie dokładnego wyznaczenia stężenia tego roztworu. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Obliczanie masy hydratu potrzebnej do przygotowania roztworu o określonym stężeniu procentowym. Zadanie 19. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Oblicz, ile gramów soli uwodnionej Na2SO4·10H2O należy dodać do 100 g roztworu, w którym stężenie Na2SO4 wynosi 6,0 % masowych, aby – po uzupełnieniu wodą do 300 g – otrzymać roztwór tej soli o stężeniu 10 %. W obliczeniach przyjmij, że masy molowe soli są równe: MNa2SO4 = 142 g·mol–1 oraz MNa2SO4·10H2O = 322 g·mol–1.
Rysowanie krzywej rozpuszczalności chloranu(V) potasu. Zadanie 20.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
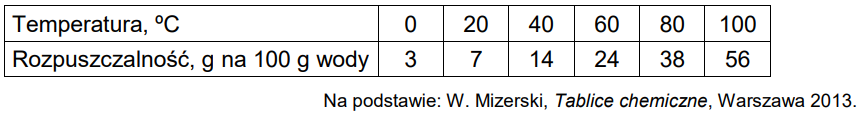
W tabeli zestawiono wartości (zaokrąglone do liczb całkowitych) rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 oC – 100 oC.
Narysuj krzywą rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 oC – 100 oC. Rozpuszczalność tej soli w wodzie jest funkcją rosnącą w całym podanym zakresie temperatury.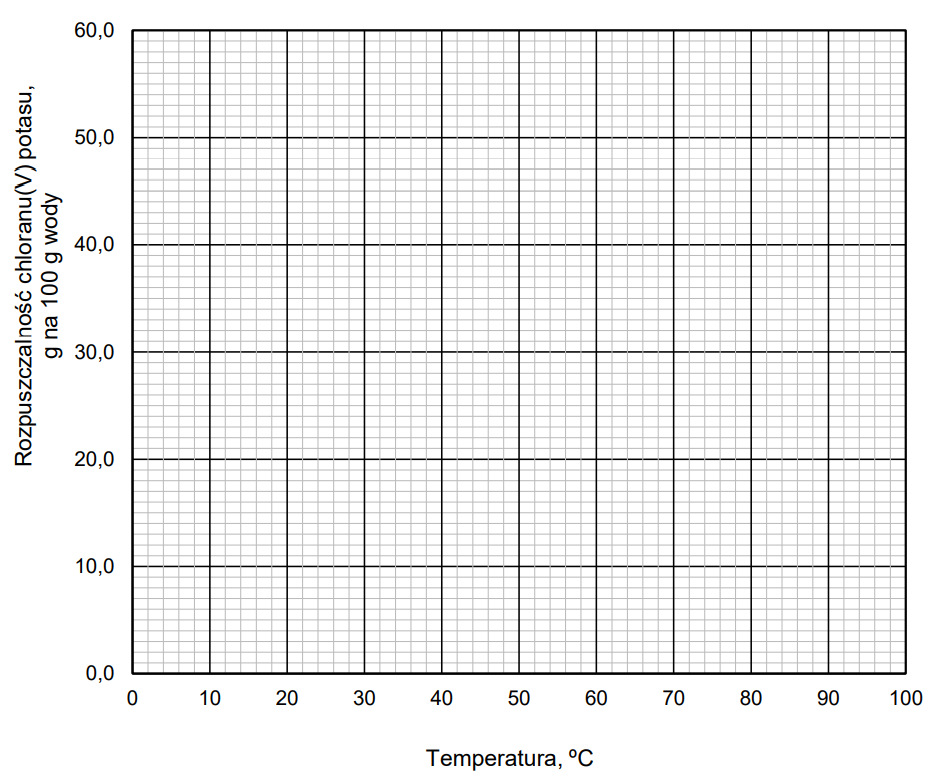
Rozstrzygnięcie, czy można otrzymać roztwór o zadanym stężeniu. Zadanie 20.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W tabeli zestawiono wartości (zaokrąglone do liczb całkowitych) rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 oC – 100 oC.

Rozstrzygnij, czy w temperaturze 20 oC można otrzymać roztwór chloranu(V) potasu o stężeniu 7% masowych. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Odczyt temperatury w której nasycony roztwór ma określone stężenie procentowe. Zadanie 20.3. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W tabeli zestawiono wartości (zaokrąglone do liczb całkowitych) rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 oC – 100 oC.

Wykonaj obliczenia i odczytaj z wykresu wartość temperatury, w której nasycony roztwór chloranu(V) potasu ma stężenie 30% masowych. Wartość temperatury podaj w zaokrągleniu do jedności.
Zapis równania reakcji chemicznej. Zadanie 21.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Teflon jest odpornym termicznie i chemicznie polimerem o nazwie systematycznej poli(tetrafluoroeten). W procesie otrzymywania tego tworzywa można wyróżnić trzy etapy.
1. Trichlorometan reaguje z fluorkiem antymonu(III) SbF3 w stosunku molowym 1 : 1. W tym etapie powstają dwa produkty. Produkt organiczny tworzy się z trichlorometanu w wyniku podstawienia dwóch atomów chloru dwoma atomami fluoru.
2. Organiczny produkt powstający w etapie 1. w temperaturze 800 oC przekształca się w związek nienasycony, a produktem ubocznym tej przemiany jest chlorowodór.
3. Organiczny produkt powstający w etapie 2. w odpowiednich warunkach ulega polimeryzacji.
Napisz równanie etapu 1.
Rozstrzygnięcie, czy dany związek występuje w postaci izomerów cis-trans z uzasadnieniem. Zadanie 21.2. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Teflon jest odpornym termicznie i chemicznie polimerem o nazwie systematycznej poli(tetrafluoroeten). W procesie otrzymywania tego tworzywa można wyróżnić trzy etapy.
1. Trichlorometan reaguje z fluorkiem antymonu(III) SbF3 w stosunku molowym 1 : 1. W tym etapie powstają dwa produkty. Produkt organiczny tworzy się z trichlorometanu w wyniku podstawienia dwóch atomów chloru dwoma atomami fluoru.
2. Organiczny produkt powstający w etapie 1. w temperaturze 800 oC przekształca się w związek nienasycony, a produktem ubocznym tej przemiany jest chlorowodór.
3. Organiczny produkt powstający w etapie 2. w odpowiednich warunkach ulega polimeryzacji.
Rozstrzygnij, czy otrzymany związek nienasycony może występować w postaci izomerów cis – trans. Odpowiedź uzasadnij. Napisz wzór półstrukturalny (grupowy) fragmentu polimeru utworzonego z dwóch cząsteczek monomeru. Rozstrzygnięcie: Uzasadnienie: Wzór fragmentu polimeru:
Wybór właściwych słów dotyczących mieszaniny nitrującej. Zadanie 22. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Mieszanina nitrująca to mieszanina dwóch stężonych kwasów: azotowego(V) i siarkowego(VI). Między jej składnikami zachodzi reakcja, w której powstaje produkt bezpośrednio reagujący z węglowodorem aromatycznym, np. z benzenem.
Uzupełnij poniższe zdania – wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Benzen ulega reakcji substytucji (elektrofilowej / nukleofilowej / rodnikowej). Drobiny, które reagują bezpośrednio z cząsteczkami benzenu podczas nitrowania, to (rodniki ·NO2 / aniony NO2– / kationy NO2+ ).
Obliczanie procentu objętościowego etynu w mieszaninie. Zadanie 23. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Przygotowano roztwór bromu w dichlorometanie (rozpuszczalniku organicznym o wzorze CH2Cl2) o stężeniu 2,0% masowych. Przez płuczkę zawierającą 280 gramów opisanego roztworu bromu przepuszczano bez dostępu światła mieszaninę etanu, etenu i etynu. Podczas doświadczenia przebiegły wyłącznie reakcje zilustrowane poniższymi równaniami:
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
Do momentu całkowitego odbarwienia roztworu bromu przez płuczkę przepuszczono 521 cm3 mieszaniny gazów (objętość gazów podano w przeliczeniu na warunki normalne). Ustalono także, że po przejściu przez płuczkę objętość mieszaniny gazów była mniejsza o 86%.
Oblicz wyrażoną w procentach objętościowych zawartość etynu w mieszaninie zawierającej etan, eten i etyn.
Wskazanie typu oraz mechanizmu reakcji. Zadanie 24. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat jest ilustracją ciągu przemian chemicznych. Substrat A to węglowodór aromatyczny, którego cząsteczki są zbudowane z siedmiu atomów węgla. W wyniku reakcji monobromowania na świetle ten węglowodór tworzy tylko jeden produkt organiczny B.
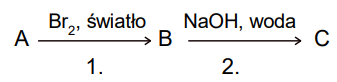
Uzupełnij poniższą tabelę. Napisz nazwę typu reakcji 1. i 2. (substytucja, addycja albo eliminacja) oraz nazwę mechanizmu (rodnikowy, nukleofilowy albo elektrofilowy), według którego przebiegają te przemiany.

