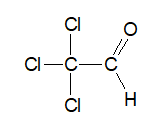
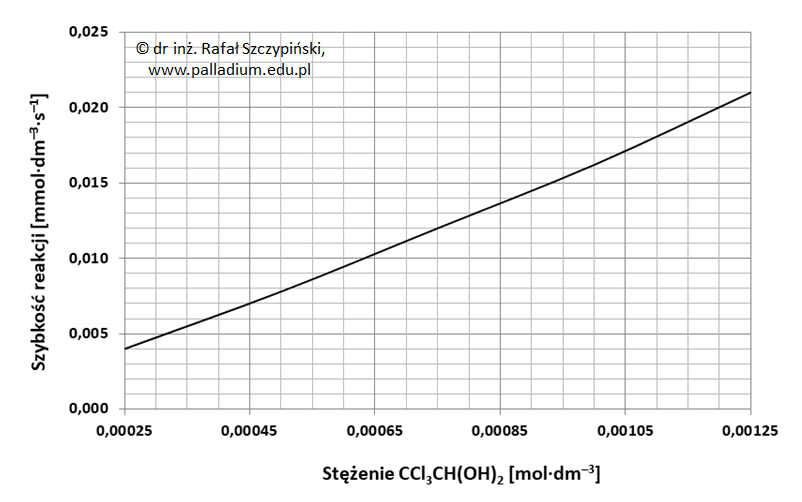
Zadanie 32. Arkusz Palladium kwiecień 2025 (1 punkt)
Aminy mogą reagować z kwasami karboksylowymi tworząc sole amoniowe, które w wyniku ogrzewania w odpowiedniej temperaturze ulegają przekształceniu w wodę oraz amidy. W przypadku amidów II-rzędowych, reszta pochodząca od kwasu karboksylowego oraz I-rzędowej aminy połączone są wiązaniem peptydowym.
Uzupełnij poniższy schemat wzorami grupowymi odpowiednich związków organicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone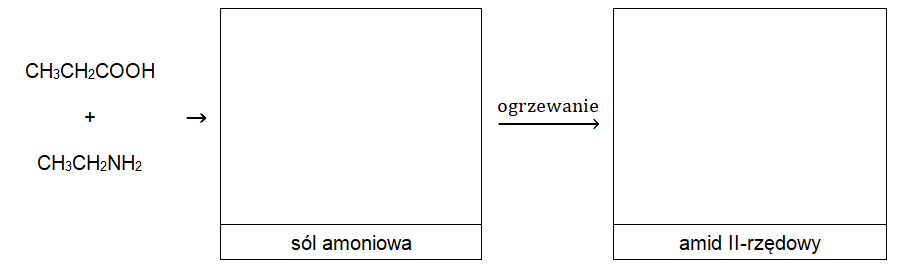
Zadanie 33. Arkusz Palladium kwiecień 2025 (1 punkt)
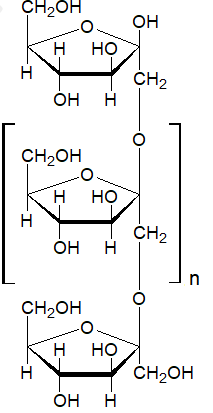
Zamieszczony rysunek przedstawia strukturę cząsteczki D-ksylozy.
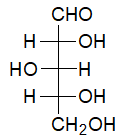
W wyniku jej redukcji powstaje związek chemiczny X zawierający wyłącznie jeden rodzaj grup funkcyjnych.
Oceń, czy wodny roztwór D-ksylozy oraz wodny roztwór związku chemicznego X wykazują czynność optyczną. Uzasadnij odpowiedź. Ocena odnośnie D-ksylozy wraz z uzasadnieniem: Ocena odnośnie związku X wraz z uzasadnieniem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzupełnienie schematu klatkowego dla stanu wzbudzonego. Zadanie 1.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywa się stanem podstawowym, a stany o wyższych energiach to stany wzbudzone. Atom X w stanie podstawowym ma elektrony rozmieszczone na trzech powłokach. Poza tym wiadomo, że dwie podpowłoki należące do zewnętrznej powłoki nie mają pustych orbitali, a jedna z nich zawiera dwa niesparowane elektrony.
W pewnych warunkach atom X w stanie podstawowym pochłonął energię. Nastąpiła zmiana stanu energetycznego tylko jednego elektronu, co spowodowało wzrost liczby niesparowanych elektronów w tym atomie. Przed wzbudzeniem stan tego elektronu był opisywany wartościami liczb kwantowych 𝑛 = 3, 𝑙 = 1, a po wzbudzeniu zmieniła się tylko wartość liczby pobocznej (orbitalnej).
Uzupełnij poniższy schemat, tak aby przedstawiał on klatkowy zapis konfiguracji elektronowej atomu X w opisanym stanie wzbudzonym.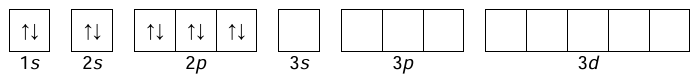
Określenie symbolu pierwiastka oraz położenia w układzie okresowym. Zadanie 1.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywa się stanem podstawowym, a stany o wyższych energiach to stany wzbudzone. Atom X w stanie podstawowym ma elektrony rozmieszczone na trzech powłokach. Poza tym wiadomo, że dwie podpowłoki należące do zewnętrznej powłoki nie mają pustych orbitali, a jedna z nich zawiera dwa niesparowane elektrony.
Uzupełnij poniższą tabelę. Wpisz symbol pierwiastka X, numer okresu i numer grupy w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy pierwiastek X.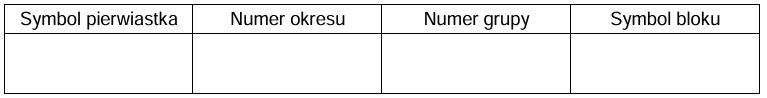
Przypisywanie liczb kwantowych orbitalom. Zadanie 2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Na poniższym rysunku przedstawiono kontury dwóch orbitali atomowych A i B należących do tej samej podpowłoki elektronowej.
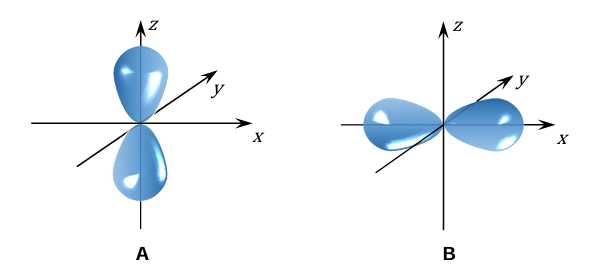
Uzupełnij zdania dotyczące przedstawionych na rysunku orbitali atomowych A i B. Najmniejsza wartość głównej liczby kwantowej 𝑛, która może opisywać każdy z przedstawionych orbitali, wynosi: . Orbital A i orbital B różnią się wartością liczby kwantowej oznaczonej symbolem .
Przypisywanie wzoru jonu i symbolu pierwiastka do wartości promieni drobin. Zadanie 3. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Atomy tlenu i atomy fluoru tworzą aniony o konfiguracji tego samego gazu szlachetnego. W tabeli przedstawiono modele atomu tlenu i atomu fluoru oraz ich prostych jonów. Dana barwa modelu odnosi się do konkretnego pierwiastka.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Uzupełnij tabelę. Napisz symbol atomu lub wzór jonu, który odpowiada każdemu z przedstawionych modeli.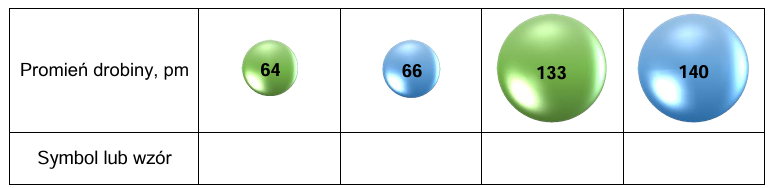
Obliczanie wydajności syntezy amoniaku. Zadanie 4. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
W temperaturze T i pod ciśnieniem p do syntezy amoniaku użyto 8,0 dm3 mieszaniny azotu i wodoru, w której objętość azotu stanowiła 25 %. Stwierdzono, że w wyniku reakcji otrzymano 5,0 dm3 mieszaniny gazów w stanie równowagi (wszystkie gazy odmierzono w tych samych warunkach).
Oblicz wydajność reakcji syntezy amoniaku w opisanych warunkach. Wynik zapisz w procentach.