Zapis równań reakcji chemicznych. Zadanie 7.2. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W probówkach oznaczonych numerami I–IV umieszczono oddzielnie, w przypadkowej kolejności, wodne roztwory soli różnych metali. Do probówek wprowadzono roztwór wodorotlenku sodu, w wyniku czego w każdej z nich pojawiła się zawiesina innego wodorotlenku:
Cr(OH)3 Ca(OH)2 Cu(OH)2 Al(OH)3
Probówkę III umieszczono na pewien czas w łaźni wodnej.
Wygląd zawartości tej probówki po ogrzaniu przedstawiono na
zdjęciu A.
Do zawiesiny wodorotlenku znajdującego się w probówce IV
dodano roztwór wodorotlenku sodu – wygląd zawartości tej
probówki przedstawiono na zdjęciu B.

Napisz równania reakcji: • w formie cząsteczkowej – termicznego rozkładu wodorotlenku znajdującego się w probówce III (reakcja 1.) Reakcja 1.: Reakcja 2.:
• w formie jonowej skróconej – roztwarzania wodorotlenku znajdującego się w probówce IV (reakcja 2.).
Obliczanie jaka część KBr uległa reakcji chemicznej. Zadanie 8. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W celu otrzymania kwasu bromowodorowego przeprowadzono doświadczenie z użyciem zestawu, który zilustrowano rysunkiem obok. Do kolby stożkowej zawierającej 9,5 g czystego stałego bromku potasu wprowadzono kroplami pewną ilość stężonego kwasu siarkowego(VI). Zaszła reakcja opisana poniższym równaniem.
KBr + H2SO4 → KHSO4 + HBr
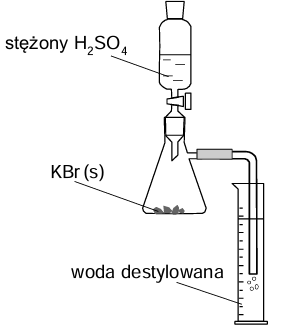
W wyniku całkowitego pochłonięcia wydzielonego bromowodoru otrzymano w cylindrze 80 cm3 kwasu bromowodorowego. Z tego roztworu pobrano próbkę 1,0 cm3, którą rozcieńczono wodą. Do jej zobojętnienia zużyto 6,9 cm3 roztworu wodorotlenku potasu o pH = 13.
Oblicz, jaka część użytego w doświadczeniu KBr uległa reakcji z H2SO4. Wynik podaj w procentach.
Zapis równań reakcji chemicznych w formie jonowej skróconej. Zadanie 9. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
Pod wyciągiem przeprowadzono dwa doświadczenia, których celem było zbadanie przebiegu reakcji metali z kwasami. Użyto poniższych odczynników:
cynk srebro kwas solny kwas azotowy(V)
Każdy z reagentów został użyty tylko raz. Przebieg doświadczeń przedstawiono na poniższych zdjęciach.

Napisz w formie jonowej skróconej równania reakcji zachodzących podczas doświadczeń 1. i 2. Doświadczenie 1.: Doświadczenie 2.:
Ustalanie wykładników potęg oraz obliczanie stałej szybkości reakcji oraz szybkości reakcji chemicznej. Zadanie 10.2. Arkusz CKE chemia maj 2025 rozszerzony (4 punkty) zadanie problemowe
W zamkniętym reaktorze zachodzi reakcja opisana równaniem:
X2 (g) + 2Y2 (g) → 2XY2 (g)
Zależność szybkości tej reakcji od stężenia opisuje poniższe równanie kinetyczne
![]()
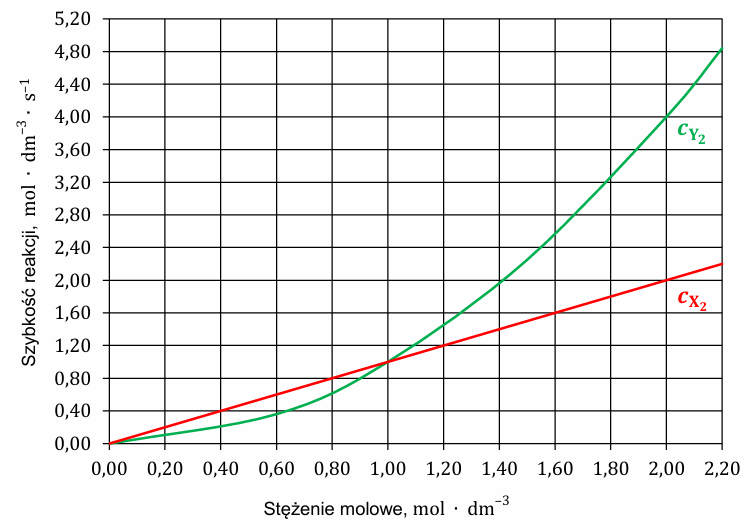
Aby wyznaczyć wykładniki 𝑎 i 𝑏 w równaniu kinetycznym, przeprowadzono serię pomiarów: w temperaturze 𝑇 mierzono zależność szybkości reakcji od stężenia jednego z substratów przy stałym stężeniu drugiego. Na podstawie wyników pomiarów sporządzono poniższe wykresy zależności szybkości reakcji od:
• stężenia substratu X2 przy stałym stężeniu CY2 = 1 mol ∙ dm–3 (linia czerwona)
• stężenia substratu Y2 przy stałym stężeniu CX2 = 1 mol ∙ dm–3 (linia zielona).
W reaktorze o pojemności 4,0 dm3 umieszczono stechiometryczną mieszaninę, zawierającą łącznie 12,0 mol gazów X2 i Y2, i zainicjowano reakcję syntezy gazu XY2. W układzie utrzymywano temperaturę 𝑇.
Na podstawie analizy wykresów ustal i napisz wartości wykładników 𝒂 i 𝒃. Następnie oblicz wartość stałej szybkości reakcji 𝒌 oraz oblicz szybkość tej reakcji w temperaturze 𝑻 w chwili, gdy w reaktorze znajdowało się łącznie 9,0 mol wszystkich gazów. Równanie kinetyczne: k: V: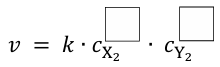
Uzupełnienie schematów reakcji zgodnie z teorią Brønsteda. Zadanie 11. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W temperaturze 𝑇 przygotowano wodne roztwory wodoroortofosforanu(V) sodu i diwodoroortofosforanu(V) sodu o jednakowych stężeniach molowych i zbadano ich odczyn za pomocą dwóch wskaźników: fenoloftaleiny oraz czerwieni obojętnej. Wyniki doświadczenia przedstawiono na poniższych zdjęciach.
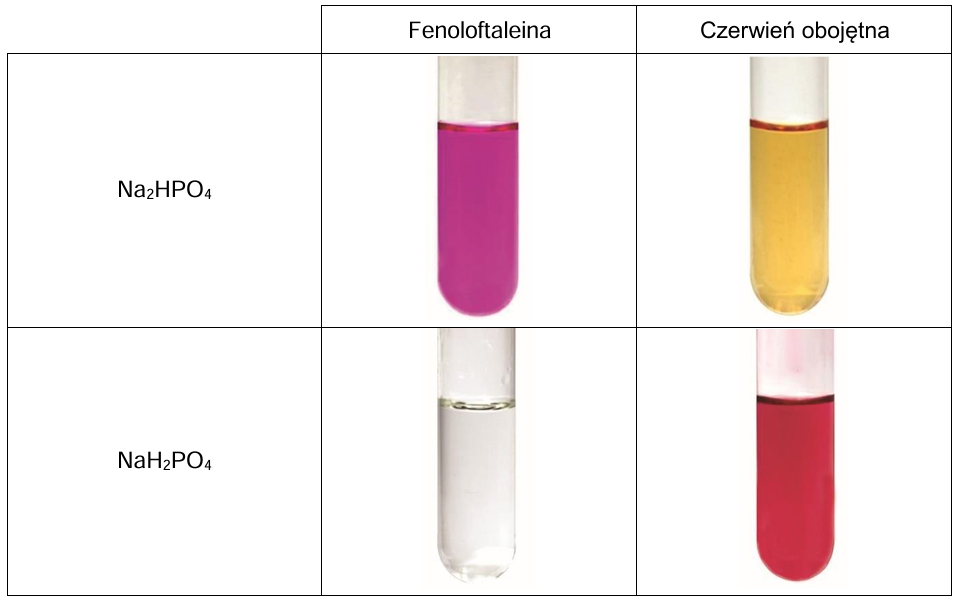
Wpisz do schematów wzory odpowiednich drobin tak, aby powstały równania reakcji decydujących o odczynie wodnego roztworu wodoroortofosforanu(V) sodu oraz o odczynie wodnego roztworu diwodoroortofosforanu(V) sodu. Zastosuj definicję kwasu i zasady Brønsteda. Równanie reakcji zachodzącej w roztworze Na2HPO4: Równanie reakcji zachodzącej w roztworze NaH2PO4: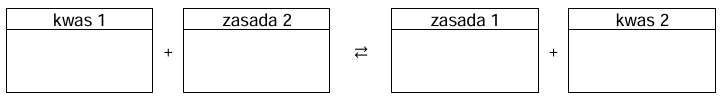

Obliczanie pH roztworu chlorku amonu oraz wskazanie właściwej fotografii. Zadanie 12. Arkusz CKE chemia maj 2025 rozszerzony (3 punkty)
Próbkę chlorku amonu o masie 0,10 g rozpuszczono w wodzie i otrzymano 100 cm3 roztworu. W powstałym roztworze kationy amonowe w pewnym stopniu ulegają przemianie zgodnie z poniższym równaniem.
NH4+ + H2O ⇄ NH3 + H3O+
Niewielką objętość przygotowanego roztworu umieszczono w probówce, do której dodano kilka kropel błękitu bromotymolowego.
Oblicz pH otrzymanego roztworu. Wynik podaj w zaokrągleniu do jednego miejsca po przecinku. Następnie wybierz zdjęcie, na którym przedstawiono wygląd zawartości probówki po dodaniu do niej wskaźnika, i zaznacz literę A, B albo C.
Obliczanie stężeniowej stałej równowagi syntezy amoniaku. Zadanie 13. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W celu wyznaczenia stężeniowej stałej równowagi syntezy amoniaku w temperaturze 𝑇 do reaktora o stałej pojemności wprowadzono azot i wodór. Początkowe stężenie azotu było równe 0,20 mol ⋅ dm–3, a początkowe stężenie wodoru wynosiło 0,60 mol ⋅ dm–3. Następnie reaktor zamknięto i utrzymywano stałą temperaturę 𝑇. W reaktorze zaszła reakcja opisana poniższym równaniem.
N2 + 3H2 ⇄ 2NH3
Po pewnym czasie stwierdzono, że ciśnienie w reaktorze obniżyło się do 75 % początkowej wartości i już się nie zmieniało.
Oblicz stężeniową stałą równowagi syntezy amoniaku w temperaturze 𝑻.
Wybór właściwych słów w nawiasach oraz wskazanie półogniwa. Zadanie 14.1. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W trzech standardowych półogniwach A, B i C ustalają się równowagi opisane poniższymi równaniami.
półogniwo A: MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O
półogniwo B: Br2 + 2ē ⇄ 2Br–
półogniwo C: Co3+ + ē ⇄ Co2+
Uzupełnij zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Następnie napisz, z którym półogniwem (B albo C) w warunkach standardowych należy połączyć półogniwo A, aby podczas pracy ogniwa malało pH roztworu w tym półogniwie. Aby podczas pracy ogniwa malało pH roztworu w półogniwie A, stężenie jonów H+ musi się (zwiększać / zmniejszać). Oznacza to, że w tym półogniwie zachodzi proces (redukcji / utleniania), a drugie półogniwo pełni funkcję (anody / katody). Opisany warunek spełnia ogniwo zbudowane z półogniwa A połączonego z półogniwem .
Uzupełnienie schematu ogniwa zgodnie z konwencją sztokholmską. Zadanie 14.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
W trzech standardowych półogniwach A, B i C ustalają się równowagi opisane poniższymi równaniami.
półogniwo A: MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O
półogniwo B: Br2 + 2ē ⇄ 2Br–
półogniwo C: Co3+ + ē ⇄ Co2+
Uzupełnij poniższy zapis tak, aby powstał schemat ogniwa galwanicznego zbudowanego z półogniw B oraz C generującego prąd w warunkach standardowych.![]()
Obliczanie energii cieplnej wydzielonej podczas spalania paliwa LPG. Zadanie 15. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
Gaz LPG, stosowany do napędu samochodów, jest mieszaniną propanu i butanu. W zbiorniku z LPG panuje ciśnienie 𝑝, w którym ta mieszanina jest cieczą. W zależności od pory roku stosuje się dwa rodzaje LPG: zimowy i letni. Skład przykładowych ciekłych mieszanin LPG (w przeliczeniu na stosunek molowy) i odpowiadające im gęstości zestawiono w tabeli.
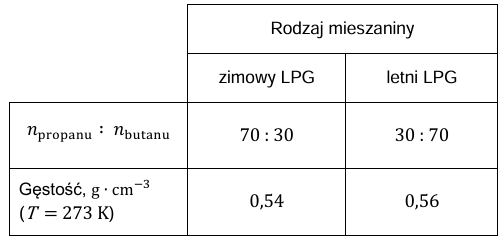
Na podstawie: https://www.e-petrol.pl
Standardowe entalpie spalania propanu i butanu podano poniżej.
• ΔHo propan (g) = –2219 kJ·mol–1
• ΔHo butan (g) = –2878kJ·mol–1
Wykonano doświadczenie. Próbkę 1,0 dm3 letniego LPG przeprowadzono w stan gazowy i spalono.
Oblicz energię, która wydzieli się do otoczenia w wyniku całkowitego spalenia 1,0 dm3 letniego LPG. Wynik podaj w kilodżulach. Przyjmij, że wartości entalpii spalania węglowodorów są takie same jak w warunkach standardowych. Załóż, że powyższe wartości nie ulegają zmianie wraz ze zmianą temperatury oraz że energia jest wymieniana z otoczeniem wyłącznie na sposób ciepła.
Uzupełnienie schematów reakcji otrzymywania alkoholi. Zadanie 17.1. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
Reakcja addycji halogenowodorów do niesymetrycznych alkenów zwykle przebiega zgodnie z regułą Markownikowa. Również przyłączenie cząsteczki wody do podwójnego wiązania, które zachodzi w środowisku kwasowym, prowadzi do powstania alkoholu o możliwie najwyższej rzędowości. Odstępstwa od tej reguły obserwuje się w reakcjach addycji wody przebiegających z udziałem wodorku boru (BH3) i nadtlenku wodoru (H2O2) w obecności jonów wodorotlenkowych (OH–). Takie postępowanie pozwala uzyskać alkohol, który jest produktem reakcji przebiegającej niezgodnie z regułą Markownikowa.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Uzupełnij poniższe schematy. Napisz w każdym z nich:
• wzór półstrukturalny (grupowy) alkenu – organicznego substratu przemiany
• niezbędne warunki prowadzenia procesu.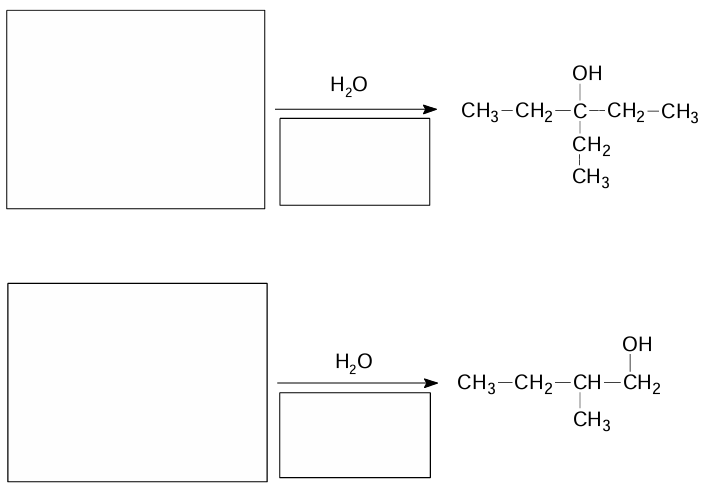
Uzupełnienie wzorów właściwymi ugrupowaniami atomów. Zadanie 17.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Reakcja addycji halogenowodorów do niesymetrycznych alkenów zwykle przebiega zgodnie z regułą Markownikowa. Również przyłączenie cząsteczki wody do podwójnego wiązania, które zachodzi w środowisku kwasowym, prowadzi do powstania alkoholu o możliwie najwyższej rzędowości. Odstępstwa od tej reguły obserwuje się w reakcjach addycji wody przebiegających z udziałem wodorku boru (BH3) i nadtlenku wodoru (H2O2) w obecności jonów wodorotlenkowych (OH–). Takie postępowanie pozwala uzyskać alkohol, który jest produktem reakcji przebiegającej niezgodnie z regułą Markownikowa.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Kamfen jest składnikiem wielu olejków eterycznych.
Uzupełnij wzory produktów przemian opisanych poniższymi schematami:
• addycji HBr przebiegającej zgodnie z regułą Markownikowa
• addycji H2O przebiegającej niezgodnie z regułą Markownikowa.
Wskazanie typu oraz mechanizmów reakcji chemicznych. Zadanie 18. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poniżej przedstawiono wzór 1,4-dimetylobenzenu, czyli p-ksylenu.
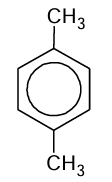
Ten związek reaguje z bromem zarówno pod wpływem światła, jak i w obecności żelaza.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Uzupełnij tabelę. Napisz nazwę typu reakcji p-ksylenu z bromem pod wpływem światła i w obecności żelaza (addycja, eliminacja albo substytucja) oraz nazwę mechanizmu (elektrofilowy, nukleofilowy albo rodnikowy), według którego przebiega każda z tych reakcji.

