Wybór właściwych zdań dotyczących reakcji związków chromu. Zadanie 21b. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Do wodnego roztworu chromianu(VI) potasu dodano kilka kropli rozcieńczonego kwasu siarkowego(VI) i stwierdzono, że roztwór zmienił barwę z żółtej na pomarańczową. Świadczyło to o powstaniu anionów dichromianowych(VI) (reakcja I). Następnie do otrzymanego roztworu wprowadzono kilka kropli roztworu wodorotlenku potasu i roztwór z powrotem stał się żółty (reakcja II).
Spośród poniższych zdań wybierz wszystkie, które są wnioskami wynikającymi z opisanego doświadczenia. I Chromiany(VI) są silnymi utleniaczami, a ich właściwości utleniające zależą od pH środowiska reakcji. II Przemiana anionów chromianowych(VI) w aniony dichromianowe(VI) jest reakcją odwracalną. III W środowisku zasadowym trwałe są aniony chromianowe(VI), a w środowisku kwasowym – aniony dichromianowe(VI). IV W środowisku zasadowym trwałe są aniony dichromianowe(VI), a w środowisku kwasowym – aniony chromianowe(VI). Numery wybranych zdań:
Wskazanie kolejności pierwiastków chemicznych wydzielanych na katodzie. Zadanie 22a. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W 1 dm3 wody rozpuszczono azotan(V) srebra(I) AgNO3, azotan(V) miedzi(II) Cu(NO3)2 oraz azotan(V) sodu NaNO3, otrzymując roztwór o jednakowych stężeniach molowych kationów. Przez otrzymany roztwór przepuszczono ładunek elektryczny w warunkach umożliwiających wydzielenie na katodzie kolejno trzech pierwiastków.
Uzupełnij poniższą tabelę, wpisując nazwy lub symbole pierwiastków w kolejności ich wydzielania na katodzie.
Wskazanie pierwiastka wydzielonego na anodzie oraz zapis równania reakcji elektrodowej. Zadanie 22b. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W 1 dm3 wody rozpuszczono azotan(V) srebra(I) AgNO3, azotan(V) miedzi(II) Cu(NO3)2 oraz azotan(V) sodu NaNO3, otrzymując roztwór o jednakowych stężeniach molowych kationów. Przez otrzymany roztwór przepuszczono ładunek elektryczny w warunkach umożliwiających wydzielenie na katodzie kolejno trzech pierwiastków.
Wiedząc, że w doświadczeniu użyto elektrod grafitowych, określ, jaki pierwiastek wydzielił się na anodzie. Odpowiedź uzasadnij, pisząc równanie reakcji anodowej. Nazwa lub symbol pierwiastka: Równanie reakcji:
Uzupełnienie schematu ogniwa oraz zapis obserwowanych zmian podczas jego pracy. Zadanie 23ab. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Zaprojektuj ogniwo galwaniczne, w którym półogniwo Ni│Ni2+ będzie pełnić funkcję anody.
a) Uzupełnij poniższy schemat, wpisując symbole lub wzory odczynników wybranych spośród następujących: Ni Ni(NO3)2 (aq) Pb Pb(NO3)2 (aq) Zn Zn(NO3)2 (aq) b) Opisz zmiany, jakie będzie można zaobserwować w półogniwach podczas pracy ogniwa. Anoda: Katoda: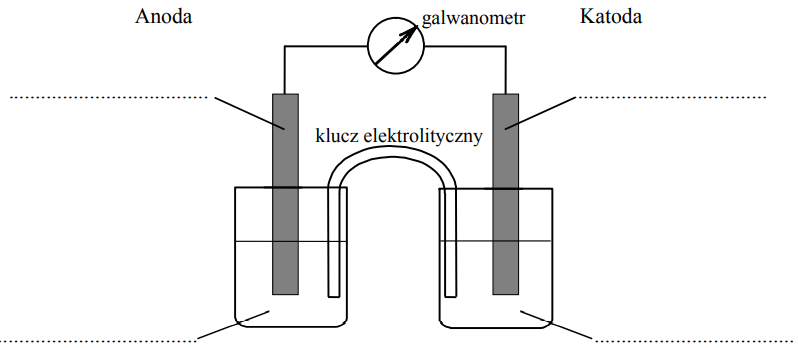
Wskazanie stopni utlenienia atomów węgla oraz liczby elektronów wymienianych podczas reakcji redoks. Zadanie 24. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
W reakcji z wodnym roztworem manganianu(VII) potasu eten utlenia się do etano-1,2-diolu (glikolu etylenowego).
Wyznacz stopnie utlenienia atomów węgla w cząsteczce etenu i cząsteczce etano-1,2-diolu oraz określ liczbę moli elektronów oddawanych przez 1 mol etenu w opisanej reakcji. Stopnie utlenienia atomów węgla w cząsteczce etenu: Stopnie utlenienia atomów węgla w cząsteczce etano-1,2-diolu: Liczba moli elektronów:
Wybór poprawnych określeń dotyczących reakcji chlorowania etanu oraz benzenu. Zadanie 25. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Na przykładzie reakcji chloru z etanem i chloru z benzenem porównaj mechanizm reakcji substytucji, którym ulegają węglowodory nasycone i aromatyczne.
Uzupełnij poniższe zdania, wybierając nazwy spośród podanych w nawiasach (wybrane nazwy podkreśl). 1. Etan ulega reakcji substytucji ( elektrofilowej / nukleofilowej / wolnorodnikowej ). Drobiny, które reagują bezpośrednio z cząsteczkami etanu, to (atomy chloru Cl· / cząsteczki chloru Cl2 / aniony chlorkowe Cl–). Są one (rodnikami / elektrofilami / nukleofilami), które powstają z cząsteczek chloru pod wpływem (światła / FeCl3 jako katalizatora / rozpuszczalnika). 2. Benzen ulega reakcji substytucji (elektrofilowej / nukleofilowej / wolnorodnikowej). Drobiny, które reagują bezpośrednio z cząsteczkami benzenu, są (rodnikami / elektrofilami / nukleofilami ). Powstają one z cząsteczek chloru pod wpływem (światła / FeCl3 jako katalizatora / rozpuszczalnika).
Zapis równań reakcji chemicznych prowadzących do utworzenia odczynnika Tollensa. Zadanie 26a. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Odczynnik Tollensa, potocznie nazywany amoniakalnym roztworem tlenku srebra, otrzymuje się przez dodanie wody amoniakalnej do wodnego roztworu AgNO3. Potoczna nazwa odczynnika nie jest poprawna, ponieważ jon O2– nie występuje w roztworach wodnych. Początkowo wytrąca się czarnobrunatny osad tlenku srebra(I). W miarę dodawania kolejnych porcji wody amoniakalnej osad ten ulega roztworzeniu, ponieważ jony srebra(I) tworzą z cząsteczkami amoniaku jony kompleksowe o wzorze [Ag(NH3)2]+ . W wyniku tej reakcji powstaje bezbarwny roztwór, który jest odczynnikiem Tollensa.
Uzupełnij poniższe zapisy, tak aby otrzymać równania (w formie jonowej) opisanych reakcji. Wpisz wzory produktów oraz brakujące współczynniki stechiometryczne.
Określenie odczynu roztworu odczynnika Tollensa. Zadanie 26b. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Odczynnik Tollensa, potocznie nazywany amoniakalnym roztworem tlenku srebra, otrzymuje się przez dodanie wody amoniakalnej do wodnego roztworu AgNO3. Potoczna nazwa odczynnika nie jest poprawna, ponieważ jon O2– nie występuje w roztworach wodnych. Początkowo wytrąca się czarnobrunatny osad tlenku srebra(I). W miarę dodawania kolejnych porcji wody amoniakalnej osad ten ulega roztworzeniu, ponieważ jony srebra(I) tworzą z cząsteczkami amoniaku jony kompleksowe o wzorze [Ag(NH3)2]+ . W wyniku tej reakcji powstaje bezbarwny roztwór, który jest odczynnikiem Tollensa.
Określ odczyn roztworu będącego odczynnikiem Tollensa.
Ocena, czy wykorzystując próbę Tollensa możliwe jest odróżnienie glukozy od fruktozy. Zadanie 27. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W roztworze o odczynie zasadowym ketony, których cząsteczki zawierają grupę hydroksylową –OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej (α-hydroksyketony), ulegają izomeryzacji. Przemianę tę ilustruje poniższy schemat.
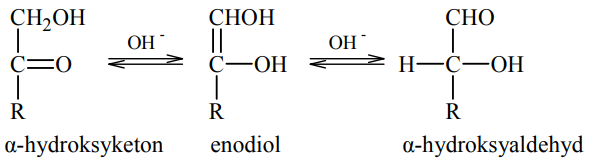
Oceń, czy za pomocą próby Tollensa można odróżnić glukozę od fruktozy. Odpowiedź uzasadnij.
Wskazanie cukrów dających pozytywny wynik próby Tollensa. Zadanie 28. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Poniżej przedstawiono wzory (w projekcji Hawortha) ilustrujące budowę wybranych mono i disacharydów.
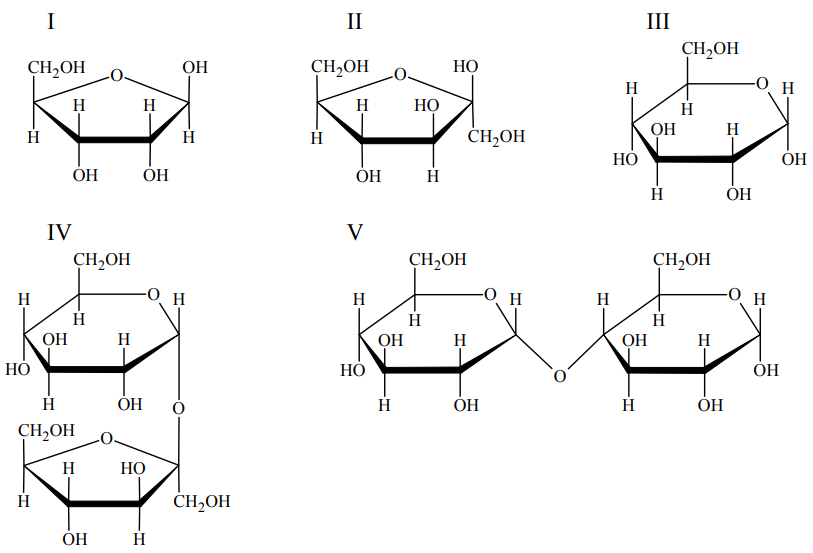
Wskaż wszystkie sacharydy, które dają pozytywny wynik próby Tollensa. Numery wzorów wybranych sacharydów:
Bilans jonowo-elektronowy reakcji glukozy z odczynnikiem Tollensa. Zadanie 29ab. Arkusz CKE chemia maj 2012 rozszerzony (3 punkty)
Reakcja glukozy z odczynnikiem Tollensa przebiega zgodnie z poniższym schematem:
CH2OH–(CHOH)4–CHO + Ag(NH3)2+ + OH– → CH2OH–(CHOH)4–COO– + Ag + NH3 + H2O
a) Napisz w formie jonowej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania. Równanie procesu redukcji: Równanie procesu utleniania: b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.![]()
Zapis wzoru sumarycznego alkanu oraz wzorów grupowych i nazw jego dwóch monochloropochodnych. Zadanie 30ab. Arkusz CKE chemia maj 2012 rozszerzony (3 punkty)
Pewien alkan o rozgałęzionym łańcuchu węglowym poddano chlorowaniu, otrzymując dwie izomeryczne monochloropochodne o masie molowej M = 92,5 g·mol–1.
a) Napisz wzór sumaryczny alkanu poddanego chlorowaniu. b) Napisz wzory półstrukturalne (grupowe) obu otrzymanych monochloropochodnych tego alkanu oraz podaj ich nazwy systematyczne.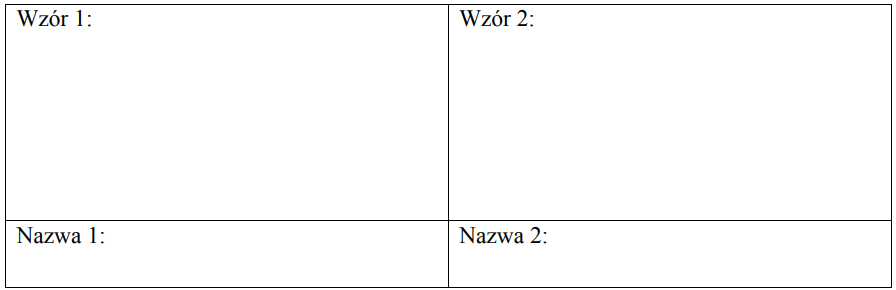
Wskazanie alkenu o największej trwałości oraz alkenu o najmniejszej trwałości. Zadanie 31. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Porównanie efektu cieplnego reakcji katalitycznego uwodornienia alkenów pozwala na porównanie trwałości tych związków. Im mniej ciepła wydziela się w reakcji uwodornienia jednego mola danego alkenu, tym jest on trwalszy. Tak określona trwałość alkenów układa się w następujący szereg:
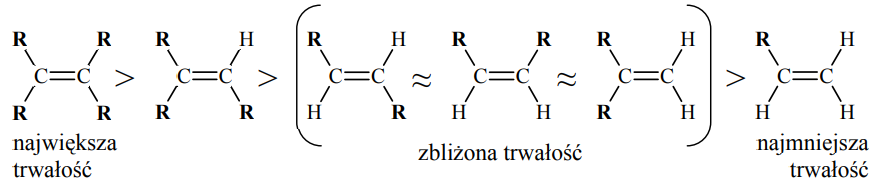
R oznacza grupę alkilową.
Na podstawie: John McMurry: Chemia organiczna, Warszawa 2000
Spośród alkenów o wzorze sumarycznym C6H12 wskaż alken o największej trwałości oraz alken o najmniejszej trwałości. Narysuj wzory półstrukturalne (grupowe) tych alkenów.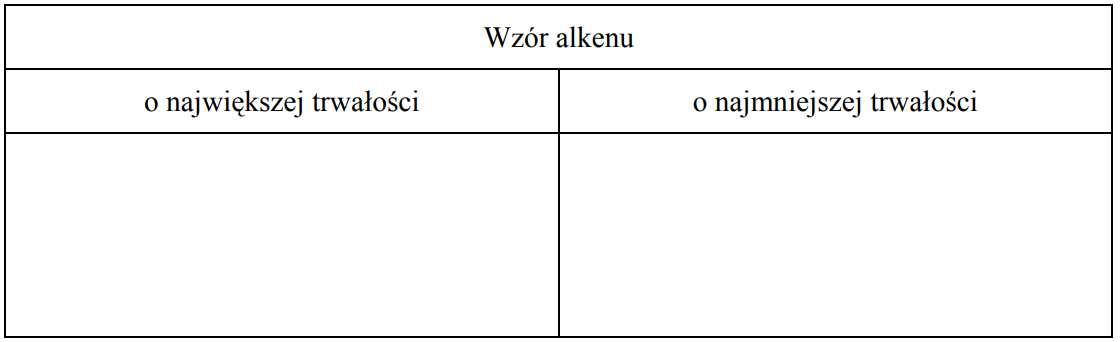
Wybór poprawnych określeń dotyczących glicerolu. Zadanie 32. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Uzupełnij poniższą charakterystykę glicerolu (propano-1,2,3-triolu), wybierając jedno określenie spośród podanych w każdym nawiasie. Wybrane określenia podkreśl.
1. W warunkach panujących w laboratorium glicerol jest cieczą, która (miesza się / nie miesza się) z wodą i z innymi rozpuszczalnikami polarnymi, a z rozpuszczalnikami niepolarnymi, np. z benzenem, może tworzyć (emulsje / zawiesiny). 2. Ponieważ atomom węgla i tlenu w cząsteczkach glicerolu można przypisać hybrydyzację sp3, cząsteczki glicerolu (są / nie są) płaskie.
Wskazanie liczby reszt alaniny i glicyny oraz możliwe sekwencje aminokwasów w peptydach. Zadanie 33. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
W wyniku hydrolizy peptydu o wzorze sumarycznym C8H15O4N3 otrzymano mieszaninę alaniny o wzorze CH3CH(NH2)COOH i glicyny o wzorze CH2(NH2)COOH.
Ustal, z ilu reszt alaniny i z ilu reszt glicyny składał się badany peptyd. Posługując się trzyliterowymi symbolami aminokwasów (Ala i Gly), napisz wszystkie możliwe sekwencje badanego peptydu. Liczba reszt alaniny (Ala): Liczba reszt glicyny (Gly): Możliwe sekwencje peptydu:

