Wskazanie rodzaju wiązania w wodorku litu oraz stopnia utlenienia wodoru. Zadanie 17a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W wyniku reakcji litowców z wodorem, prowadzonej w podwyższonej temperaturze, powstają wodorki o wzorze ogólnym MeH. Związki te są w temperaturze pokojowej ciałami stałymi, a po stopieniu przewodzą prąd elektryczny. Po wprowadzeniu ich do wody wydziela się wodór, a roztwór po dodaniu fenoloftaleiny przyjmuje malinowe zabarwienie.
Uwzględniając podany opis właściwości fizycznych wodorku litu i wiedząc, że jego temperatura topnienia wynosi 692 oC, określ rodzaj wiązania występującego w tym związku oraz podaj stopień utlenienia, jaki przyjmuje wodór w tym związku. Rodzaj wiązania: Stopień utlenienia wodoru:
Wskazanie rodzaju wiązania w wodorku litu oraz stopnia utlenienia wodoru. Zadanie 17b. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W wyniku reakcji litowców z wodorem, prowadzonej w podwyższonej temperaturze, powstają wodorki o wzorze ogólnym MeH. Związki te są w temperaturze pokojowej ciałami stałymi, a po stopieniu przewodzą prąd elektryczny. Po wprowadzeniu ich do wody wydziela się wodór, a roztwór po dodaniu fenoloftaleiny przyjmuje malinowe zabarwienie.
Napisz w formie cząsteczkowej równanie reakcji otrzymywania wodorku litu oraz równanie reakcji wodorku litu z wodą. Równanie reakcji otrzymywania wodorku litu: Równanie reakcji wodorku litu z wodą:
Zapis równań reakcji elektrodowych reakcji biegnących podczas elektrolizy stopionego wodorku litu. Zadanie 17c. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W wyniku reakcji litowców z wodorem, prowadzonej w podwyższonej temperaturze, powstają wodorki o wzorze ogólnym MeH. Związki te są w temperaturze pokojowej ciałami stałymi, a po stopieniu przewodzą prąd elektryczny. Po wprowadzeniu ich do wody wydziela się wodór, a roztwór po dodaniu fenoloftaleiny przyjmuje malinowe zabarwienie.
Napisz równania reakcji elektrodowych zachodzących w czasie elektrolizy stopionego wodorku litu, wiedząc, że na anodzie wydziela się wodór. Równanie reakcji katodowej: Równanie reakcji anodowej:
Wskazanie przybliżonej wartości energii dysocjacji wiązania C–H. Zadanie 18a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Energia dysocjacji wiązania C–H w alkanach (wyrażona w kJ·mol–1) to energia, jaką trzeba dostarczyć, aby przekształcić 1 mol alkanu w 1 mol atomów wodoru i 1 mol odpowiedniego rodnika organicznego. Przykłady takich procesów oraz odpowiadające im energie dysocjacji zestawiono w poniższej tabeli.
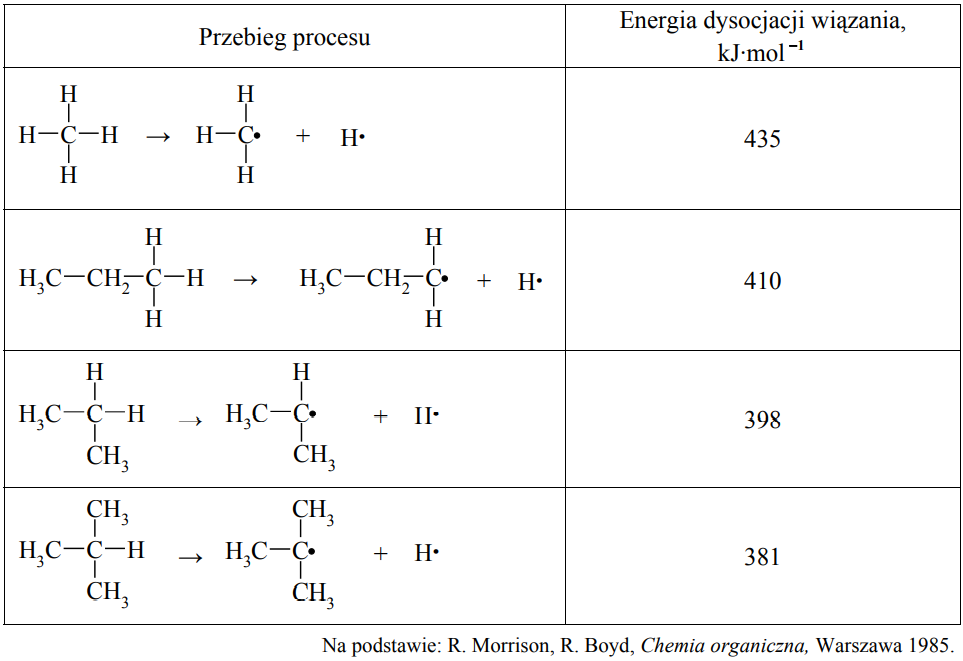
Można zauważyć, że łatwość odrywania atomu wodoru od cząsteczki alkanu zależy od rzędowości atomu węgla, z którym jest on połączony.
Korzystając z informacji, podkreśl przybliżoną wartość energii dysocjacji wiązania C–H w etanie. 435 kJ·mol–1 410 kJ·mol–1 398 kJ·mol–1 381 kJ·mol–1
Wybór najłatwiej tworzącego się rodnika. Zadanie 18b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Energia dysocjacji wiązania C–H w alkanach (wyrażona w kJ·mol–1) to energia, jaką trzeba dostarczyć, aby przekształcić 1 mol alkanu w 1 mol atomów wodoru i 1 mol odpowiedniego rodnika organicznego. Przykłady takich procesów oraz odpowiadające im energie dysocjacji zestawiono w poniższej tabeli.

Można zauważyć, że łatwość odrywania atomu wodoru od cząsteczki alkanu zależy od rzędowości atomu węgla, z którym jest on połączony.
Spośród rodników, których wzory podano w informacji, wybierz i napisz wzór tego, który tworzy się najłatwiej.
Zapis wzorów grupowych węglowodorów będących produktami reakcji addycji dwóch cząsteczek 2-metylopropenu. Zadanie 19a. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W temperaturze około 80 °C i w obecności kwasu siarkowego(VI) cząsteczki 2-metylopropenu ulegają dimeryzacji zachodzącej według schematu:
![]()
W mieszaninie poreakcyjnej stwierdza się obecność dwóch alkenów o podanym wzorze sumarycznym, różniących się położeniem wiązania podwójnego w cząsteczce. W wyniku całkowitego uwodornienia mieszaniny powstaje jeden związek 2,2,4-trimetylopentan.
Napisz wzory półstrukturalne (grupowe) obu izomerów, powstających w reakcji addycji dwóch cząsteczek 2-metylopropenu. Izomer I: Izomer II:
Wskazanie mechanizmu reakcji chemicznej. Zadanie 19b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W temperaturze około 80 °C i w obecności kwasu siarkowego(VI) cząsteczki 2-metylopropenu ulegają dimeryzacji zachodzącej według schematu:
![]()
W mieszaninie poreakcyjnej stwierdza się obecność dwóch alkenów o podanym wzorze sumarycznym, różniących się położeniem wiązania podwójnego w cząsteczce. W wyniku całkowitego uwodornienia mieszaniny powstaje jeden związek 2,2,4-trimetylopentan.
Określ, według jakiego mechanizmu, nukleofilowego czy elektrofilowego, przebiega reakcja uwodornienia każdego z opisanych izomerów, w wyniku której powstaje 2,2,4-trimetylopentan.
Zapis wzoru grupowego związku organicznego. Zadanie 20a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Poniżej przedstawiony jest schemat przemian, które w laboratorium chemicznym prowadzą do otrzymania związku Z.
![]()
Podaj wzór półstrukturalny (grupowy) związku organicznego X.
Zapis równań reakcji chemicznych z udziałem związków organicznych. Zadanie 20b. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
Poniżej przedstawiony jest schemat przemian, które w laboratorium chemicznym prowadzą do otrzymania związku Z.
![]()
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji oznaczonej na schemacie numerem 2 oraz równanie reakcji Równanie reakcji oznaczonej numerem 2: Równanie reakcji oznaczonej numerem 3:
oznaczonej na schemacie numerem 3.
Zapis równań reakcji addycji oraz substytucji przebiegających przy udziale propenu i chloru. Zadanie 21. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W zależności od warunków przeprowadzania eksperymentu reakcja propenu z chlorem może przebiegać w różny sposób. W temperaturze pokojowej, w obojętnym rozpuszczalniku (np. CCl4) reakcją preferowaną jest addycja. W temperaturze 500–600 °C (w fazie gazowej) reakcją uprzywilejowaną jest substytucja, podczas której podstawieniu ulega atom wodoru w grupie alkilowej.
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji opisanych w informacji. Zaznacz warunki prowadzenia obu procesów. Równanie reakcji addycji: Równanie reakcji substytucji:
Ocena poprawności zdań dotyczących schematu reakcji z udziałem metylobenzenu. Zadanie 22. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Podstawnik już wprowadzony do pierścienia aromatycznego wywiera wpływ na miejsce wprowadzenia do pierścienia kolejnego podstawnika. Grupy alkilowe, –Cl, –Br, –NH2, –OH kierują kolejny wprowadzany podstawnik w pozycje orto- i para- w stosunku do własnego położenia. Obecność w pierścieniu aromatycznym grupy –NO2, –COOH czy –CHO powoduje, że kolejny podstawnik jest wprowadzany głównie w pozycję meta-. Poniższy schemat ilustruje ciąg przemian chemicznych, w wyniku których powstają związki organiczne A, B i C.
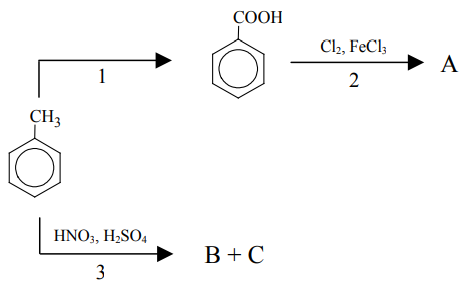
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe. 1. W przemianie oznaczonej numerem 1 stopień utlenienia atomu węgla wchodzącego w skład podstawnika rośnie. 2. W przemianie oznaczonej numerem 2 głównym produktem jest kwas p-chlorobenzenokarboksylowy (p-chlorobenzoesowy). 3. Uczestniczący w przemianie oznaczonej numerem 3 jon NO2+ powstaje w reakcji kwasu azotowego(V) z kwasem siarkowym(VI).
Zapis wzorów uproszczonych związków chemicznych. Zadanie 23a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Podstawnik już wprowadzony do pierścienia aromatycznego wywiera wpływ na miejsce wprowadzenia do pierścienia kolejnego podstawnika. Grupy alkilowe, –Cl, –Br, –NH2, –OH kierują kolejny wprowadzany podstawnik w pozycje orto- i para- w stosunku do własnego położenia. Obecność w pierścieniu aromatycznym grupy –NO2, –COOH czy –CHO powoduje, że kolejny podstawnik jest wprowadzany głównie w pozycję meta-. Poniższy schemat ilustruje ciąg przemian chemicznych, w wyniku których powstają związki organiczne A, B i C.

Napisz wzory półstrukturalne (grupowe) lub uproszczone związków organicznych B i C, które są głównymi produktami przemiany oznaczonej na schemacie numerem 3. Wzór związku B: Wzór związku C:
Zapis równania reakcji chemicznej przedstawionej na schemacie. Zadanie 23b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Podstawnik już wprowadzony do pierścienia aromatycznego wywiera wpływ na miejsce wprowadzenia do pierścienia kolejnego podstawnika. Grupy alkilowe, –Cl, –Br, –NH2, –OH kierują kolejny wprowadzany podstawnik w pozycje orto- i para- w stosunku do własnego położenia. Obecność w pierścieniu aromatycznym grupy –NO2, –COOH czy –CHO powoduje, że kolejny podstawnik jest wprowadzany głównie w pozycję meta-. Poniższy schemat ilustruje ciąg przemian chemicznych, w wyniku których powstają związki organiczne A, B i C.

Stosując wzory pólstrukturalne (grupowe) lub uproszczone związków organicznych, napisz równanie reakcji, oznaczonej na schemacie numerem 2, prowadzącej do otrzymania głównego produktu organicznego.
Przyporządkowanie nazw wzorom kwasów HX, HY oraz HZ. Zadanie 24a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W poniższej tabeli podane są wartości stałej dysocjacji wybranych kwasów organicznych w temperaturze 25 °C.

Trzy kwasy HX, HY i HZ różnią się mocą. W temperaturze 25 °C stosunek stałych dysocjacji KHZ : KHY jest równy 0,1. Kwas HX reaguje z solą NaY zgodnie ze schematem:
HX + NaY → NaX + HY
Skorzystaj z powyższej informacji i przyporządkuj wzorom HX, HY, HZ nazwy odpowiednich kwasów. HX: HY: HZ:
Określenie wpływu na moc kwasu wprowadzenie podstawnika –Cl. Zadanie 24b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W poniższej tabeli podane są wartości stałej dysocjacji wybranych kwasów organicznych w temperaturze 25 °C.

Trzy kwasy HX, HY i HZ różnią się mocą. W temperaturze 25 °C stosunek stałych dysocjacji KHZ : KHY jest równy 0,1. Kwas HX reaguje z solą NaY zgodnie ze schematem:
HX + NaY → NaX + HY
Napisz, jaki wpływ na moc kwasu ma wprowadzenie do pierścienia kwasu benzenokarboksylowego w pozycję orto- kolejnego podstawnika takiego jak –Cl.

