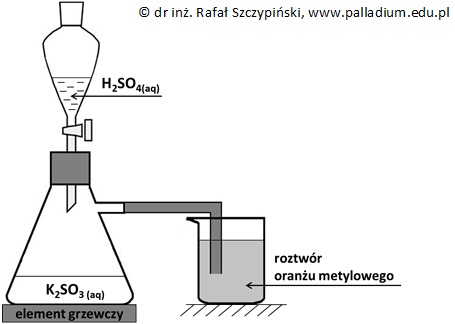
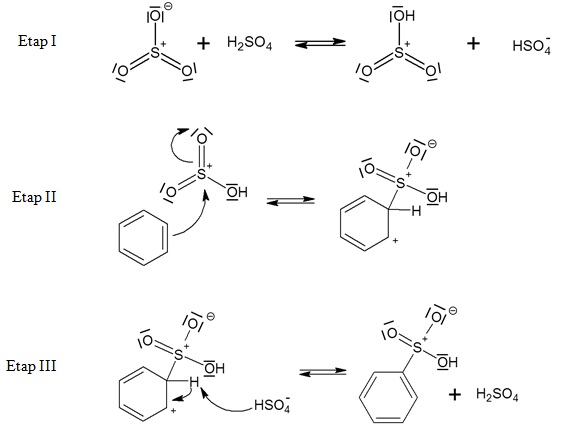
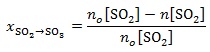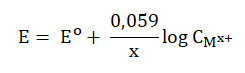Podczas dwóch etapów produkcji kwasu siarkowego(VI), w fazie gazowej przebiegają następujące reakcje chemiczne:
S + O2 ⟶ SO2 ΔHo = –297 kJ
2SO2 + O2 ⇄ 2SO3 ΔHo = –196 kJ
W przypadku drugiej z wymienionych przemian stosuje się katalizatory będące związkami wanadu, w których pierwiastkowi temu przypisuje się stopień utlenienia równy V.
Miarą wydajności reakcji utleniania tlenku siarki(IV) do tlenku siarki(VI) jest tzw. równowagowy stopień przemiany x, który opisany jest wyrażeniem:
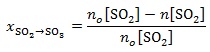
We wzorze tym no[SO2] to początkowa liczba moli SO2, natomiast n[SO2] jest liczbą moli tego gazu, jaka pozostała po ustaleniu się stanu równowagi.
Rysunek poniżej ilustruje zależność równowagowego stopnia przemiany tlenku siarki(IV) od temperatury pod ciśnieniem 0,1 MPa, gdy procentowy skład objętościowy wyjściowej mieszaniny gazów był następujący: 7% SO2, 11% O2 oraz 82% N2.
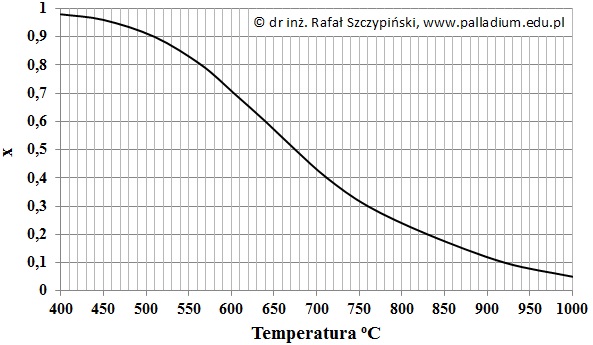
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Opisany proces prowadzono w reaktorze o stałej pojemności.
Oblicz procent objętościowy tlenku siarki(VI) w równowagowej mieszaninie gazów w temperaturze 510 oC. Przyjmij, że w tych warunkach prowadzenia procesu azot zawarty w wyjściowej mieszaninie jest substancją bierną chemicznie. Wynik podaj z dokładnością do dwóch cyfr znaczących.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone