Obliczanie liczby wiązań peptydowych na podstawie danych ilościowych reakcji hydrolizy peptydu. Zadanie 32. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
W wyniku hydrolizy 2,03 g pewnego peptydu o masie molowej równej 609,74 g · mol–1 otrzymano 2,27 g mieszaniny aminokwasów.
Oblicz, ile wiązań peptydowych zawiera cząsteczka badanego peptydu.
Wskazanie właściwej fotografii przedstawiającej efekt wykonanego doświadczenia chemicznego. Zadanie 33. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Przeprowadzono doświadczenie polegające na dodaniu świeżo strąconego wodorotlenku miedzi(II) do probówki zawierającej wodny roztwór biuretu H2N–CO–NH–CO–NH2.
Spośród poniższych ilustracji wybierz i zaznacz tę, która przedstawia efekt opisanego doświadczenia.
Wybór właściwego monomeru do reakcji otrzymywania poliizoprenu. Zadanie 34. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Poniżej przedstawiono wzór kauczuku naturalnego.
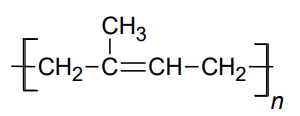
Dokończ zdanie. Zaznacz właściwą odpowiedź spośród podanych. W laboratorium ten związek można otrzymać w reakcji polimeryzacji A. 2-metylobut-1-enu. B. 2-metylobuta-1,3-dienu. C. 2-metylobut-2-enu. D. 2-metylobuta-1,2-dienu.
Ocena poprawności zdań dotyczących D-allozy. Zadanie 35. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
D-alloza to jeden z izomerów D-glukozy. W pewnych warunkach ten cukier może zostać utleniony do kwasu aldonowego lub kwasu aldarowego, co przedstawiono na poniższym schemacie.
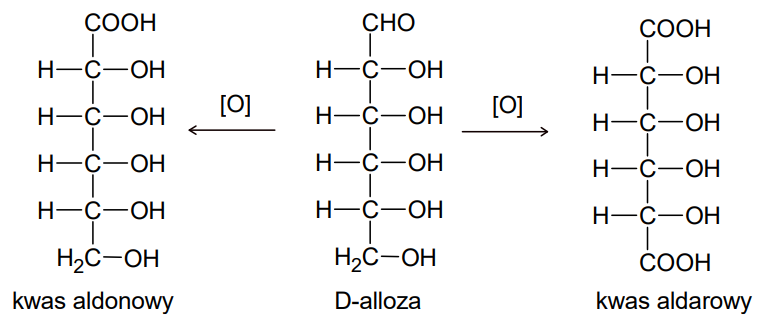
Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Cząsteczki kwasu aldarowego otrzymanego w wyniku utleniania D-allozy są chiralne. 2. Reakcja D-allozy z wodnym roztworem bromu prowadzi do uzyskania kwasu aldonowego.
Zapis nazwy jednego z produktów reakcji oraz wzoru drugiego produktu. Zadanie 36. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Amigdalina to związek chemiczny z grupy glikozydów, występujący w znacznych ilościach w gorzkich migdałach. Wzór amigdaliny przedstawiono poniżej.
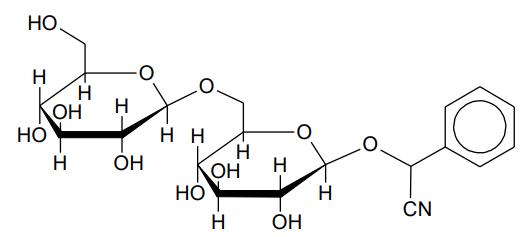
W wyniku hydrolizy amigdaliny zachodzącej w organizmie pod wpływem enzymów powstają trzy rodzaje drobin: cyjanowodór o wzorze HCN oraz dwa związki chemiczne, które w poniższym schemacie reakcji oznaczono literami A i B:
amigdalina + 2H2O → 2A + B + HCN
O związkach A i B wiadomo, że w odpowiednich warunkach ulegają reakcji z odczynnikiem Tollensa.
Napisz nazwę związku A oraz narysuj wzór związku B powstających w reakcji hydrolizy amigdaliny. Nazwa związku A: Wzór związku B:
Określanie symboli dwóch pierwiastków chemicznych oraz liczby ich elektronów niesparowanych. Zadanie 1. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Dwa pierwiastki, oznaczone numerami 1. i 2., należą do czwartego okresu układu okresowego. Liczba atomowa pierwiastka 1. jest mniejsza od liczby atomowej pierwiastka 2. Atomy (w stanie podstawowym) tych pierwiastków mają 4 elektrony, które mogą uczestniczyć w tworzeniu wiązań chemicznych.
Uzupełnij tabelę. Napisz nazwy pierwiastków 1. i 2. oraz określ, czy w atomach (w stanie podstawowym) tych pierwiastków występują niesparowane elektrony – podaj liczbę elektronów niesparowanych i napisz symbol podpowłoki, do której one należą, albo zaznacz, że nie ma takich elektronów.
Graficzny zapis konfiguracji elektronowej kationu bromoniowego. Zadanie 2. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Uzupełnij poniższy schemat tak, aby przedstawiał on graficzny zapis konfiguracji elektronowej kationu bromoniowego Br+ (stan podstawowy). W tym zapisie uwzględnij numery powłok i symbole podpowłok.
Wybór związku chemicznego zawierającego jony chlorkowe. Zadanie 3. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Spośród wymienionych poniżej substancji wybierz te, w skład których wchodzą jony Cl–. Podkreśl wzory wybranych związków. HCl (g) KCl (s) CH3Cl (g) CH3NH3Cl (s) NaClO (s) CaCl2 · 6H2O (s)
Wybór procesów, w których biorą udział rodniki chloru. Zadanie 4.1. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Poniżej przedstawiono schematy czterech przemian chemicznych A, B, C i D, w których jednym z substratów jest chlor.

Spośród przemian oznaczonych literami A, B, C i D wybierz te, w przebiegu których udział biorą rodniki chloru. Napisz litery, którymi oznaczono te przemiany.
Określenie efektu energetycznego reakcji chemicznej. Zadanie 5. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
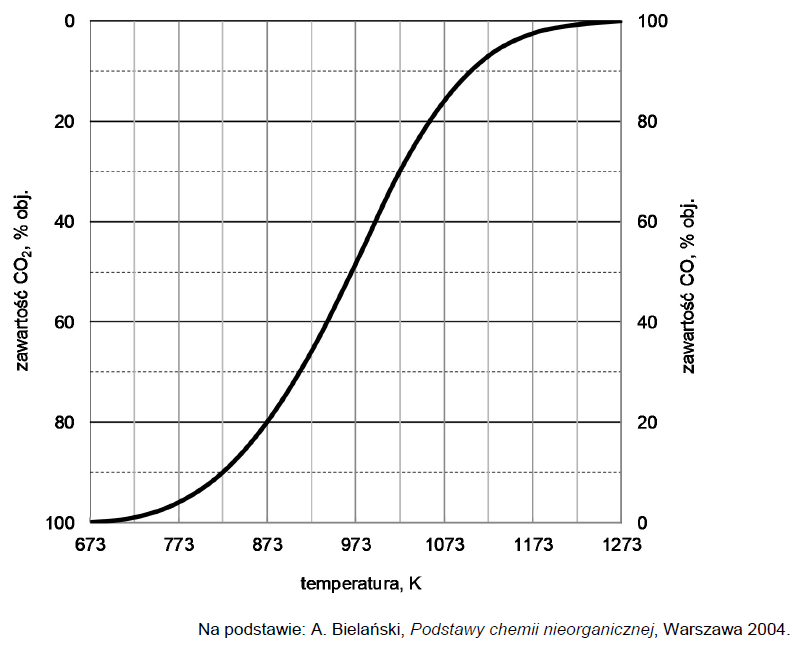
Rozstrzygnij, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem egzoenergetycznym. Uzasadnij swoją odpowiedź. Rozstrzygnięcie: Uzasadnienie:
Obliczanie wartości stałej stężeniowej reakcji chemicznej. Zadanie 6. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.

W mieszaninie gazów doskonałych sumaryczne stężenie molowe wyraża się wzorem:
![]()
gdzie:
𝑝 – ciśnienie w hPa
𝑇 – temperatura w K
𝑅 – stała gazowa równa 83,1 hPa∙dm3∙K–1∙mol–1.
Ponadto

Oblicz wartość stężeniowej stałej równowagi opisanej przemiany w temperaturze 873 K i pod ciśnieniem 1013 hPa. Wyrażenie na stężeniową stałą równowagi tej reakcji przyjmuje postać: Załóż, że CO i CO2 są gazami doskonałymi.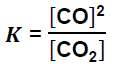
Zapis równań reakcji chemicznych z udziałem sodu, litu, tlenu i azotu. Zadanie 8. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa. Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli, a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu, związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia. Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
Napisz w formie cząsteczkowej równania opisanych w informacji przemian. Spalanie sodu w tlenie: Reakcja litu z azotem:
Określenie czy w wyniku przeprowadzenia różnych doświadczeń chemicznych uzyskano czysty tlenek magnezu. Zadanie 9.1. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa. Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli, a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu, związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia. Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
W celu otrzymania tlenku magnezu przeprowadzono dwa doświadczenia: I i II. W doświadczeniu I tlenek magnezu otrzymano przez całkowity rozkład MgCO3. W doświadczeniu II tlenek magnezu otrzymano przez spalenie magnezu w powietrzu.
Rozstrzygnij, czy w obu doświadczeniach otrzymano czysty tlenek magnezu. Uzasadnij odpowiedź. Rozstrzygnięcie: Uzasadnienie: