Zapis obserwacji oraz równania reakcji chemicznej w formie jonowej skróconej. Zadanie 12.2. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
– do probówki 1. – kilka kropel roztworu fenoloftaleiny
– do probówki 2. – nadmiar stężonego HCl (aq).
Napisz, co zaobserwowano podczas doświadczenia w probówce 2. po dodaniu odczynnika. Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną zaobserwowanych zmian. Obserwacje: Równanie reakcji:
Rozstrzygnięcie czy miareczkowany kwas jest mocny czy słaby z dwoma uzasadnieniami. Zadanie 13. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (2 punkty)
Badano reakcje mocnego kwasu HA i słabego kwasu HX z mocną zasadą. W tym celu wykonano miareczkowanie wodnych roztworów tych kwasów za pomocą wodnego roztworu wodorotlenku potasu – zgodnie z poniższym opisem. Umieszczono w zlewce 20,0 cm3 roztworu wybranego kwasu o stężeniu 0,10 mol ∙ dm−3 i zmierzono pH tego roztworu. Następnie do zlewki z roztworem kwasu dodawano porcjami wodny roztwór KOH o stężeniu 0,10 mol ∙ dm−3 . Po dodaniu każdej porcji roztworu wodorotlenku mierzono pH mieszaniny reakcyjnej. Punkt równoważnikowy (PR) został osiągnięty po dodaniu takiej objętości roztworu KOH, w jakiej liczba moli zasady jest równa liczbie moli kwasu. Uzyskane wyniki przedstawiono w formie wykresu zależności mierzonego pH od objętości roztworu KOH – naniesione punkty połączono, w wyniku czego otrzymano krzywą miareczkowania. Poniżej przedstawiono krzywą miareczkowania wodnego roztworu jednego z tych kwasów (HA albo HX) wodnym roztworem wodorotlenku potasu.
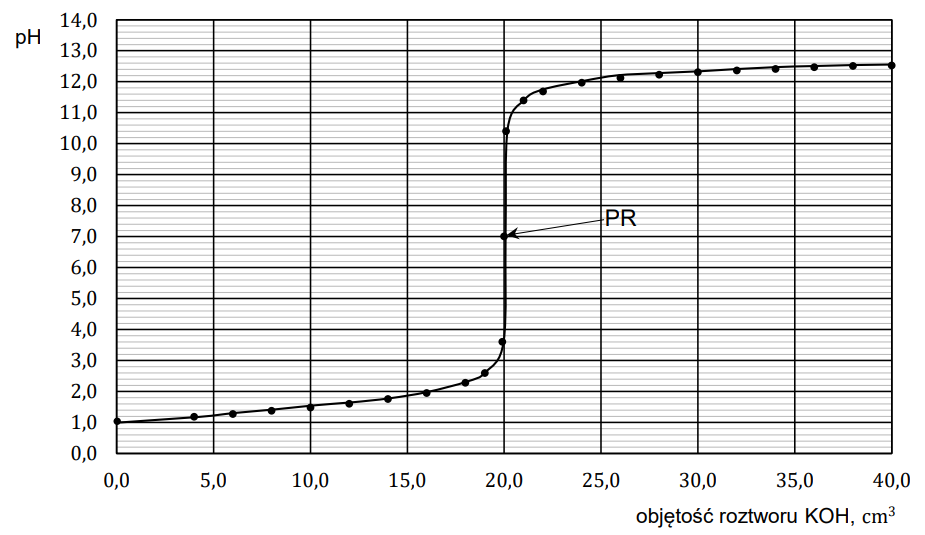
Rozstrzygnij, czy przedstawiony wykres ilustruje wyniki miareczkowania wodnego roztworu słabego kwasu HX wodnym roztworem KOH w opisanym doświadczeniu. Odpowiedź uzasadnij – przytocz dwa różne argumenty. Uzasadnienie: 1. 2.
Obliczanie wartości pH nasyconego roztworu wody amoniakalnej. Zadanie 14. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (2 punkty)
W temperaturze 25 °C rozpuszczalność amoniaku w wodzie jest równa 46 g w 100 g wody.
Na podstawie: K. H. Lautenschläger i in., Nowoczesne kompendium chemii, Warszawa 2007.
Oblicz pH wodnego roztworu amoniaku nasyconego w tej temperaturze, jeżeli jego gęstość jest równa 0,91 g∙cm–𝟑 . Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Określanie odczynu wodnych roztworów soli. Zadanie 15. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Wymieszano po dwa wodne roztwory różnych soli o stężeniu ok. 0,5 mol ∙ dm−3 . W ten sposób otrzymano roztwory A i B, których skład podany jest w poniższej tabeli.

Określ odczyn roztworów A i B. Odczyn roztworu A: Odczyn roztworu B:
Wybór właściwych wyrazów w nawiasach. Zadanie 16. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Przygotowano wodne roztwory następujących substancji:
1. kwasu azotowego(V) o stężeniu 0,5 mol ∙ dm−3
2. kwasu octowego (etanowego) o stężeniu 0,5 mol ∙ dm−3
3. wodorotlenku baru o pH = 11 4. wodorotlenku potasu o pH = 11.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wartość pH roztworu kwasu azotowego(V) jest (większa niż / mniejsza niż / taka sama jak) wartość pH roztworu kwasu octowego. Spośród roztworów o odczynie zasadowym mniejsze stężenie molowe ma roztwór numer (3 / 4).
Zapis równań przebiegających reakcji chemicznych w dwuetapowym procesie. Zadanie 17.1. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Czysty tlenek wapnia można otrzymać w laboratorium w wyniku prażenia szczawianu wapnia o wzorze CaC2O4. Podczas ogrzewania szczawian wapnia najpierw rozkłada się na węglan wapnia i tlenek węgla(II) (reakcja 1.). Dalsze ogrzewanie, w wyższej temperaturze, prowadzi do rozkładu węglanu wapnia na tlenek wapnia i tlenek węgla(IV) (reakcja 2.). Tlenek wapnia jest ciałem stałym o temperaturze topnienia równej 2858 K. Energicznie reaguje z wodą, a przemianie tej towarzyszy wydzielanie się znacznej ilości ciepła.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz równanie reakcji, która zachodzi w pierwszym etapie rozkładu termicznego szczawianu wapnia (reakcja 1.), i równanie reakcji, która zachodzi w drugim etapie tego procesu (reakcja 2.). Równanie reakcji 1.: Równanie reakcji 2.:
Ocena poprawności zdań. Zadanie 17.2. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Czysty tlenek wapnia można otrzymać w laboratorium w wyniku prażenia szczawianu wapnia o wzorze CaC2O4. Podczas ogrzewania szczawian wapnia najpierw rozkłada się na węglan wapnia i tlenek węgla(II) (reakcja 1.). Dalsze ogrzewanie, w wyższej temperaturze, prowadzi do rozkładu węglanu wapnia na tlenek wapnia i tlenek węgla(IV) (reakcja 2.). Tlenek wapnia jest ciałem stałym o temperaturze topnienia równej 2858 K. Energicznie reaguje z wodą, a przemianie tej towarzyszy wydzielanie się znacznej ilości ciepła.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Tlenek wapnia jest związkiem jonowym. 2. Entalpia reakcji tlenku wapnia z wodą Δ𝐻 < 0.
Obliczanie procentu masowego węglanu wapnia. Zadanie 18. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (2 punkty)
W celu określenia zawartości węglanu wapnia w mieszaninie dwóch soli, zawierającej również węglan magnezu, próbkę tej mieszaniny o masie 2,84 g roztworzono w kwasie. Podczas analizy przebiegły reakcje chemiczne:
CaCO3 (s) + 2H3O+ (aq) → Ca2+ (aq) + CO2 (g) + 3H2O (c)
MgCO3 (s) + 2H3O+ (aq) → Mg2+ (aq) + CO2 (g) + 3H2O (c)
W wyniku zachodzących reakcji otrzymano 672 cm3 tlenku węgla(IV) w przeliczeniu na warunki normalne.
Oblicz wyrażoną w procentach masowych zawartość CaCO3 w badanej próbce mieszaniny.
Rysowanie krzywej rozpuszczalności amoniaku. Zadanie 19. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Dane w poniższej tabeli pokazują zależność rozpuszczalności amoniaku w wodzie od temperatury.

Narysuj krzywą rozpuszczalności amoniaku w wodzie w zakresie temperatury od 20 °C do 80 °C i odczytaj – w zaokrągleniu do jedności – wartość rozpuszczalności tego gazu w temperaturze 68 °C. Rozpuszczalność amoniaku w wodzie w podanym zakresie temperatury jest funkcją malejącą. Rozpuszczalność amoniaku w temperaturze 68 °C: g w 100 g wody.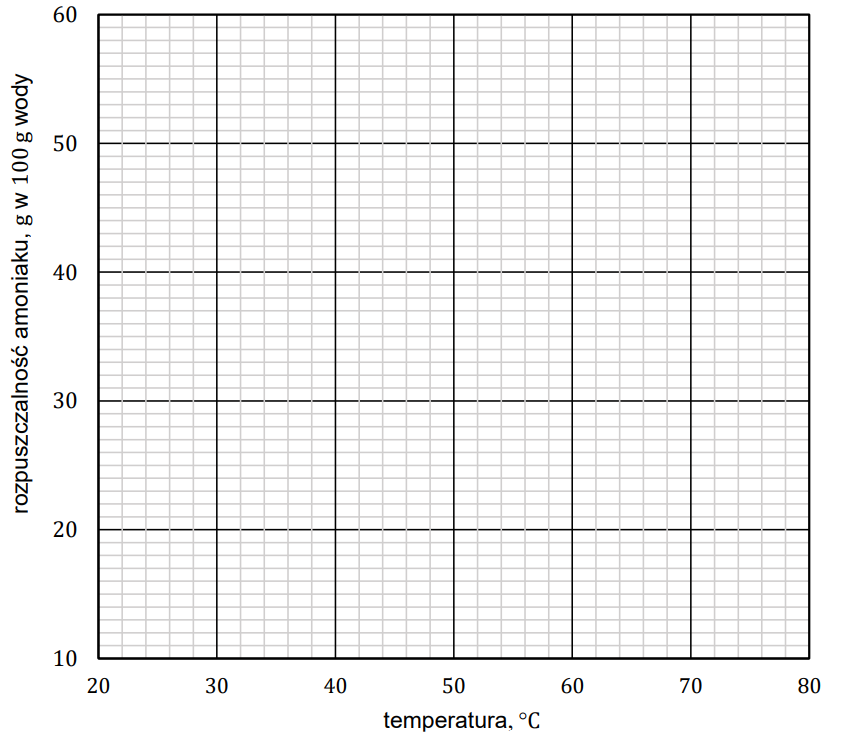
Wyznaczanie wzoru sumarycznego hydratu chlorku wapnia. Zadanie 20. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (2 punkty)
Chlorek wapnia tworzy rozpuszczalne hydraty o wzorze ogólnym CaCl2 ∙ 𝑛H2O. W zależności od temperatury w równowadze z roztworem nasyconym pozostają hydraty o różnych wartościach współczynnika 𝑛. W temperaturze 40 °C jeden z hydratów chlorku wapnia rozpuszcza się w ilości 767,4 g na 100 g wody, a stężenie nasyconego roztworu chlorku wapnia wynosi 53,66 % masowych.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wykonaj obliczenia i napisz wzór opisanego hydratu chlorku wapnia
Uzupełnienie współczynnikami stechiometrycznymi schematu reakcji redoks. Zadanie 21. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
W środowisku wodnym aniony tiosiarczanowe reagują z chlorem zgodnie ze schematem:
S2O32– + Cl2 + H2O → SO42– + Cl– + H3O+
Podczas tej reakcji aniony tiosiarczanowe ulegają utlenieniu, które przebiega według schematu:
S2O32– + 15H2O → 2SO42– + 10H3O+ + 𝑥e–
Uzupełnij współczynniki stechiometryczne w poniższym schemacie reakcji. ……. S2O32– + …….Cl2 + …….H2O → ……. SO42– + …….Cl– + …….H3O+
Zapis równania reakcji redukcji z udziałem jonów zawierających technet. Zadanie 22. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Technet, podobnie jak mangan, jest pierwiastkiem, który w związkach chemicznych może występować na VI stopniu utlenienia. Jony TcO42− są trwałe jedynie w środowisku silnie zasadowym, natomiast w roztworach obojętnych ulegają dysproporcjonowaniu, zgodnie ze schematem:
TcO42− + H2O → TcO4− + TcO2 + OH–
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Napisz w formie jonowej skróconej, z uwzględnieniem liczby wymienianych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji.
Uzupełnienie schematu z wyborem wzorów odpowiednich odczynników. Zadanie 23. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Przeprowadzono doświadczenie, podczas którego do probówek I i II z wodnymi roztworami pewnych substancji dodano jeden, taki sam odczynnik. W obu probówkach zaszły reakcje utleniania i redukcji. Po zakończeniu doświadczenia w obu probówkach widoczny był brunatny osad.
Uzupełnij schemat przeprowadzonego doświadczenia. Zaznacz wzory substancji, których wodne roztwory znajdowały się w probówkach I i II, oraz wzór odczynnika dodanego do obu probówek.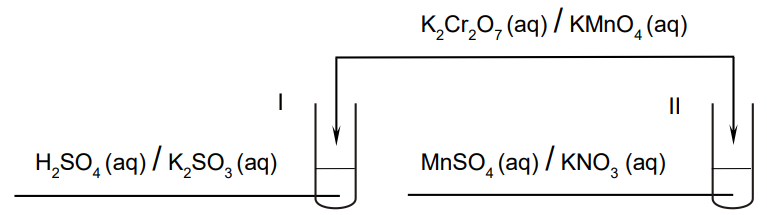
Obliczanie liczby atomów węgla w cząsteczce alkanu. Zadanie 24. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Pewien alkan, którego achiralne cząsteczki mają rozgałęziony łańcuch węglowy, w temperaturze 𝑇 i pod ciśnieniem 𝑝 jest gazem i ma gęstość 50 razy większą od gęstości wodoru wyznaczonej w tych samych warunkach. W reakcji chlorowania tego alkanu może powstać 6 różnych monochloropochodnych, będących izomerami konstytucyjnymi (bez uwzględniania stereoizomerów).
Oblicz liczbę atomów węgla w cząsteczce opisanego alkanu oraz napisz jego wzór półstrukturalny (grupowy).
Wyjaśnienie wzrostu równowagowego stopnia przemiany ze wzrostem ciśnienia. Zadanie 25.1. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Reakcję hydratacji (uwodnienia) etenu opisuje równanie:
![]()
Równowagowy stopień przereagowania etenu, który jest miarą wydajności przedstawionej reakcji, zależy od warunków prowadzenia procesu: temperatury i ciśnienia. Tę zależność przedstawiono na poniższym wykresie.
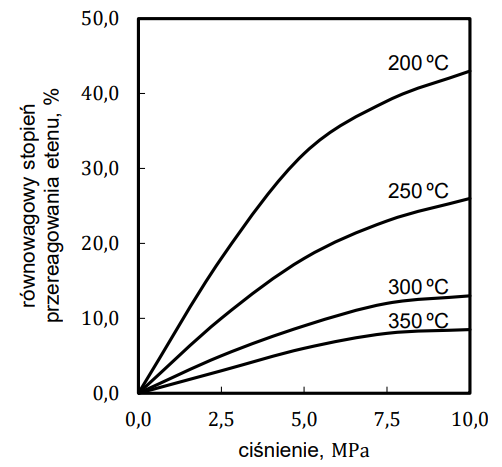
Na podstawie: E. Grzywa, J. Molenda, Technologia podstawowych syntez organicznych, Warszawa 2008.
Wyjaśnij, dlaczego w danej temperaturze równowagowy stopień przereagowania etenu w opisanej reakcji jest tym większy, im wyższe jest ciśnienie, pod którym prowadzona jest reakcja.