Określanie symboli pierwiastków chemicznych. Zadanie 1.1. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
• należą do tego samego bloku konfiguracyjnego
• liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
• suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
Uzupełnij tabelę. Wpisz symbol pierwiastka A i symbol pierwiastka X oraz symbol bloku konfiguracyjnego, do którego należą te pierwiastki.
Graficzny zapis walencyjnej konfiguracji elektronowej atomu pierwiastka w stanie podstawowym. Zadanie 1.2. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
• należą do tego samego bloku konfiguracyjnego
• liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
• suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
Napisz fragment konfiguracji elektronowej atomu A (w stanie podstawowym) opisujący rozmieszczenie elektronów walencyjnych na podpowłokach. Zastosuj graficzny zapis konfiguracji elektronowej. W tym zapisie uwzględnij numer powłoki i symbole podpowłok.
Obliczanie bezwzględnej masy cząsteczki związku chemicznego. Zadanie 1.3. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
• należą do tego samego bloku konfiguracyjnego
• liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
• suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
Pierwiastki A i X tworzą związek o wzorze AX4.
Oblicz bezwzględną masę (wyrażoną w gramach) jednej cząsteczki AX4 złożonej jedynie z atomów tych izotopów, które opisano we wstępie do zadania. Przyjmij, że masa atomowa izotopu jest równa jego liczbie masowej.
Rozstrzygnięcie której odmiany alotropowej węgla dotyczy informacja. Zadanie 2. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Poniżej przedstawiono informacje o jednej z odmian alotropowych węgla oraz model jej struktury krystalicznej.
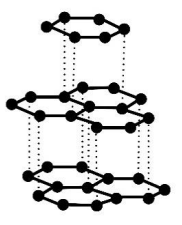
Występuje w postaci miękkiego minerału o słabym metalicznym połysku. Ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności i ciepła.
Występuje w postaci miękkiego minerału o słabym metalicznym połysku. Ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności i ciepła. Rozstrzygnięcie: Wyjaśnienie:
Ocena poprawności zdań dotyczących grafitu i diamentu. Zadanie 3. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Odmienna budowa wewnętrzna diamentu, grafitu i fulerenów jest przyczyną różnic ich właściwości chemicznych, przy zachowaniu identycznych właściwości fizycznych. 2. W krysztale diamentu każdy z atomów węgla tworzy kowalencyjne wiązania 𝜎 z czterema otaczającymi go atomami.
Wybór drobin spełniających określone kryteria. Zadanie 4. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Z podanego zbioru:
NH4+ H2O BCl3 CH4
wybierz i napisz wzór tej drobiny, w której: 1. orbitalom walencyjnym atomu centralnego przypisuje się hybrydyzację sp2: 2. atom centralny może być akceptorem pary elektronowej:
Rysowanie wzoru elektronowego cząsteczki ditlenku triwęgla oraz wskazanie liczby wiązań sigma oraz atomów węgla o hybrydyzacji sp. Zadanie 5. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (2 punkty)
Ze względu na zdolność atomów węgla do łączenia się w łańcuchy ten pierwiastek tworzy z tlenem nie tylko związki takie jak CO i CO2, lecz także mniej typowe połączenia. Jednym z nich jest ditlenek triwęgla o wzorze sumarycznym C3O2. Cząsteczka tego związku ma budowę liniową, atomami wewnętrznymi są w niej atomy węgla, a skrajnymi – atomy tlenu. Ditlenek triwęgla reaguje z wodą. W tej reakcji powstaje jeden produkt – kwas dikarboksylowy.
Na podstawie: J.E. House, Inorganic Chemistry, Elsevier, 2008.
Narysuj wzór elektronowy cząsteczki C3O2 (zaznacz kreskami wiązania chemiczne i wolne pary elektronowe). Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wzór elektronowy: Aby wyjaśnić budowę cząsteczki C3O2, hybrydyzację typu sp przypisuje się orbitalom walencyjnym (trzech atomów / dwóch atomów / jednego atomu) węgla. Liczba wiązań sigma w cząsteczce C3O2 wynosi (2 / 4 / 6 / 8).
Rysowanie wzoru półstrukturalnego produktu reakcji ditlenku triwęgla z wodą. Zadanie 6. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Ze względu na zdolność atomów węgla do łączenia się w łańcuchy ten pierwiastek tworzy z tlenem nie tylko związki takie jak CO i CO2, lecz także mniej typowe połączenia. Jednym z nich jest ditlenek triwęgla o wzorze sumarycznym C3O2. Cząsteczka tego związku ma budowę liniową, atomami wewnętrznymi są w niej atomy węgla, a skrajnymi – atomy tlenu. Ditlenek triwęgla reaguje z wodą. W tej reakcji powstaje jeden produkt – kwas dikarboksylowy.
Na podstawie: J.E. House, Inorganic Chemistry, Elsevier, 2008.
Narysuj wzór półstrukturalny (grupowy) produktu reakcji ditlenku triwęgla z wodą.
Wybór bardziej lotnego związku z wyjaśnieniem. Zadanie 7. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
W poniższej tabeli podano wzory dwóch związków organicznych: alkoholu benzylowego i etylobenzenu, a także wartości masy molowej oraz temperatury wrzenia tych związków.

Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozstrzygnij, który związek – alkohol benzylowy czy etylobenzen – jest substancją bardziej lotną. Wyjaśnij, dlaczego alkohol benzylowy i etylobenzen znacznie różnią się wartościami temperatury wrzenia. Odnieś się do wpływu różnicy w budowie cząsteczek obu związków na ich właściwości fizykochemiczne. Rozstrzygnięcie: Wyjaśnienie:
Obliczanie stałej równowagi reakcji syntezy BrCl. Zadanie 8. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Reakcja rozkładu chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
2BrCl (g) ⇄ Br2 (g) + Cl2 (g)
Wartość stężeniowej stałej równowagi reakcji rozkładu chlorku bromu(I) w temperaturze 500 K jest równa 32.
Na podstawie: L. Jones, P. Atkins, Chemia ogólna, Warszawa 2009.
Reakcja syntezy chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
Br2 (g) + Cl2 (g) ⇄ 2BrCl (g)
Oblicz wartość stężeniowej stałej równowagi reakcji syntezy chlorku bromu(I) w temperaturze 𝟓𝟎𝟎 𝐊.
Wybór mocniejszego kwasu z uzasadnieniem wyboru. Zadanie 9. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze. Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (a) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20 °C.
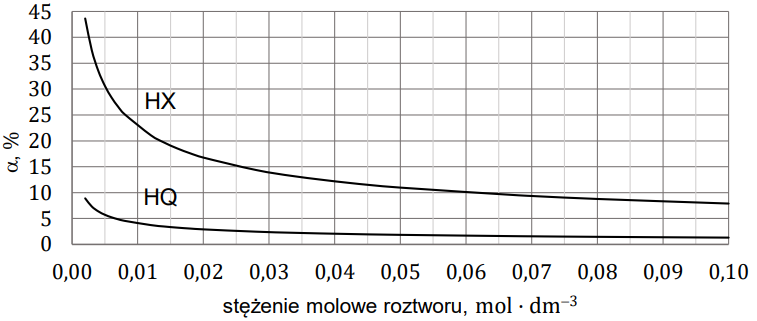
Wartości stopnia dysocjacji kwasu HX dla wybranych stężeń molowych (𝑐0) zebrano w tabeli (𝑡 = 20 °C).
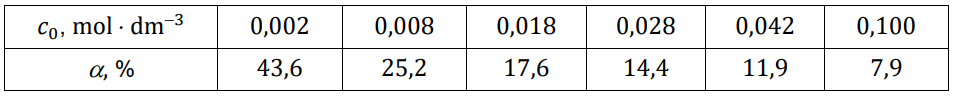
Rozstrzygnij, na podstawie analizy danych zamieszczonych na wykresie, który kwas (HX czy HQ) jest mocniejszy. Zaznacz jego wzór. Odpowiedź uzasadnij. HX HQ Uzasadnienie:
Wybór odczynników oraz jonowy zapis równań reakcji chemicznych. Zadanie 10.1. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (3 punkty)
Sole można otrzymać m.in. w reakcjach:
1. soli kwasu I z kwasem II mocniejszym od kwasu I
2. wodorotlenku z tlenkiem kwasowym.
Uzupełnij schemat doświadczenia, w którym można otrzymać: KOH (aq) HCl (aq) C6H5OH Ba(OH)2 (aq) Na2CO3 (aq) (NH4)3PO4 (aq) Następnie napisz w formie jonowej równania reakcji, które zaszły w kolbie oraz w probówce podczas tego doświadczenia. Równanie reakcji zachodzącej w kolbie: Równanie reakcji zachodzącej w probówce:
– w kolbie rozpuszczalną w wodzie sól metodą 1.
– w probówce nierozpuszczalną sól metodą 2.
Wzory użytych odczynników wybierz spośród następujących: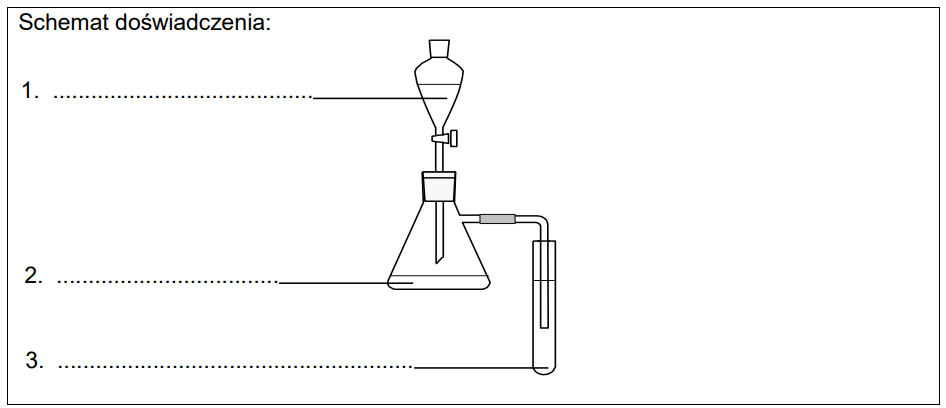
Wybór odpowiedniej czynności. Zadanie 10.2. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Sole można otrzymać m.in. w reakcjach:
1. soli kwasu I z kwasem II mocniejszym od kwasu I
2. wodorotlenku z tlenkiem kwasowym.
Podczas opisanego doświadczenia dodano z wkraplacza do kolby stechiometryczną ilość reagenta.
Spośród czynności, których nazwy podano poniżej, wybierz tę, którą należy wykonać w celu wyodrębnienia jonowego produktu reakcji z mieszaniny poreakcyjnej, powstałej w kolbie. Zaznacz jej nazwę. odparowanie pod wyciągiem odwirowanie sączenie
Wybór par drobin które nie tworzą sprzężonej pary kwas-zasada Brønsteda. Zadanie 11. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Spośród wymienionych par drobin wybierz i zaznacz wszystkie te, które nie tworzą sprzężonej pary Brønsteda kwas – zasada.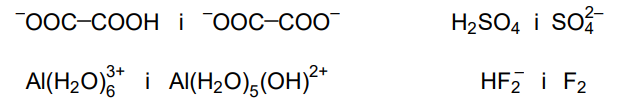
Zapis równania procesu zgodnie z teorią Brønsteda i wskazaniem sprzężonych par kwasów oraz zasad. Zadanie 12.1. Arkusz CKE chemia maj 2023 rozszerzony formuła 2015 (1 punkt)
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
– do probówki 1. – kilka kropel roztworu fenoloftaleiny
– do probówki 2. – nadmiar stężonego HCl (aq).
Zawartość probówki 1., po dodaniu do niej roztworu fenoloftaleiny, zabarwiła się na kolor czerwonoróżowy (malinowy).
Wpisz do schematu wzory odpowiednich drobin tak, aby powstało równanie procesu decydującego o odczynie roztworu w probówce 1. Zastosuj definicję kwasu i zasady Brønsteda.