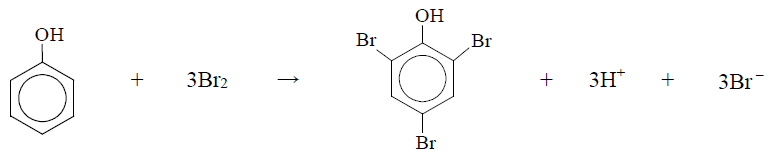
Wybór poprawnych określeń dotyczących reakcji bromowania fenolu. Zadanie 28. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Oznaczanie zawartości fenolu w ściekach przemysłowych możne przebiegać w kilku etapach opisanych poniżej.
Etap I: Otrzymywanie bromu.
Etap II: Bromowanie fenolu.
Etap III: Wydzielanie jodu.
Etap IV: Miareczkowanie jodu.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Fenol, który jest pochodną benzenu zawierającą grupę hydroksylową związaną z pierścieniem, ulega podczas etapu II oznaczania reakcji substytucji (elektrofilowej / nukleofilowej / rodnikowej). Bromowanie benzenu wymaga użycia katalizatora, natomiast reakcja fenolu z bromem przebiega łatwo już w temperaturze pokojowej. Można więc wnioskować, że grupa hydroksylowa związana z pierścieniem benzenowym (ułatwia / utrudnia) podstawienie atomów (bromu / wodoru) atomami (bromu / wodoru).
Określanie z uzasadnieniem czy alkohole i etery o tej samej liczbie atomów węgla w cząsteczce są względem siebie izomerami. Zadanie 29.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Etery są związkami o wzorze R−O−R’, przy czym R i R’ mogą być zarówno grupami alkilowymi, jak i arylowymi. W poniższej tabeli zestawiono wartości temperatury wrzenia tw (pod ciśnieniem 1013 hPa) wybranych alkoholi oraz wybranych eterów o nierozgałęzionych cząsteczkach.
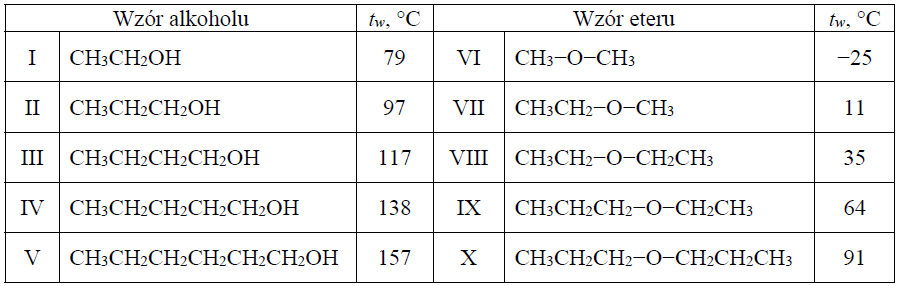
Na podstawie: L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
Czy alkohole i etery o tej samej liczbie atomów węgla w cząsteczce są izomerami? Uzasadnij swoją odpowiedź. Odnieś się do związków, których wzory wymieniono w tabeli.
Wybór najmniej i najbardziej lotnego związku chemicznego oraz wyjaśnienie większej lotności eterów niż alkoholi. Zadanie 29.2. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Etery są związkami o wzorze R−O−R’, przy czym R i R’ mogą być zarówno grupami alkilowymi, jak i arylowymi. W poniższej tabeli zestawiono wartości temperatury wrzenia tw (pod ciśnieniem 1013 hPa) wybranych alkoholi oraz wybranych eterów o nierozgałęzionych cząsteczkach.

Na podstawie: L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
Spośród związków o wzorach podanych w tabeli wybierz substancję najmniej lotną i substancję najbardziej lotną. Napisz numery, którymi oznaczono wzory wybranych związków. Następnie wyjaśnij, dlaczego etery są bardziej lotne niż alkohole o tej samej masie cząsteczkowej. Odnieś się do budowy cząsteczek związków, których wzory wymieniono w tabeli. Numer związku najmniej lotnego: Numer związku najbardziej lotnego: Wyjaśnienie:
Określenia wartości stopni utlenienia atomów węgla oraz przypisywanie typów hybrydyzacji. Zadanie 30. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Poniżej przedstawiono wzory: cykloheksanonu, cykloheksanolu i kwasu adypinowego. Literami a, b i c oznaczono wybrane atomy węgla.
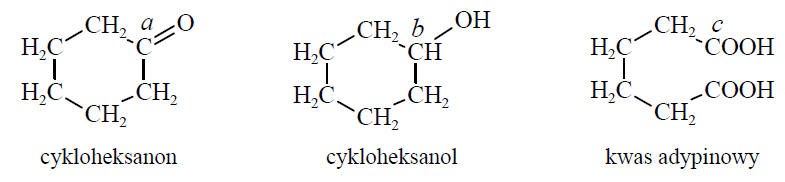
Określ formalne stopnie utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) atomów węgla oznaczonych w podanych wzorach literami a, b i c. Uzupełnij tabelę.
Określanie liczb moli elektronów oddanych w reakcjach utleniania cykloheksanolu i cykloheksanonu. Zadanie 31. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Kwas adypinowy jest ważnym surowcem w produkcji tworzyw sztucznych. Na skalę techniczną otrzymuje się go przez utlenianie mieszaniny cykloheksanonu oraz cykloheksanolu. Poniżej przedstawiono równania tych przemian.
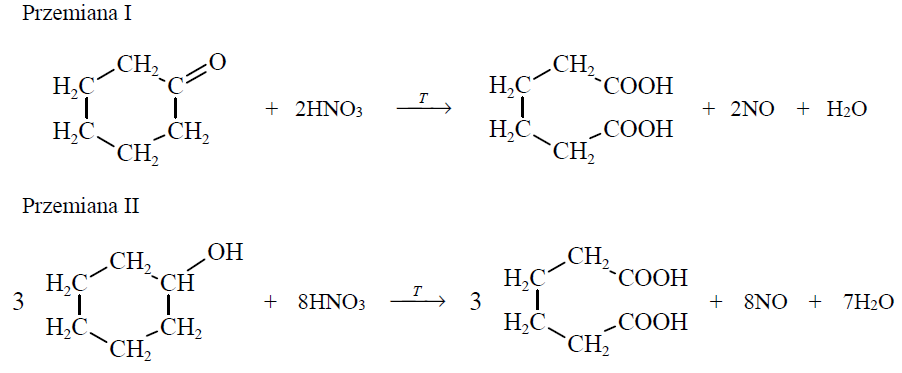
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Podaj liczbę moli elektronów oddawanych przez 1 mol cykloheksanonu i 1 mol cykloheksanolu podczas opisanych przemian. Przemiana I: Przemiana II:
Zapis równania reakcji kwasu mrówkowego z zakwaszonym roztworem manganianu(VII) potasu. Zadanie 32. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym schemacie.
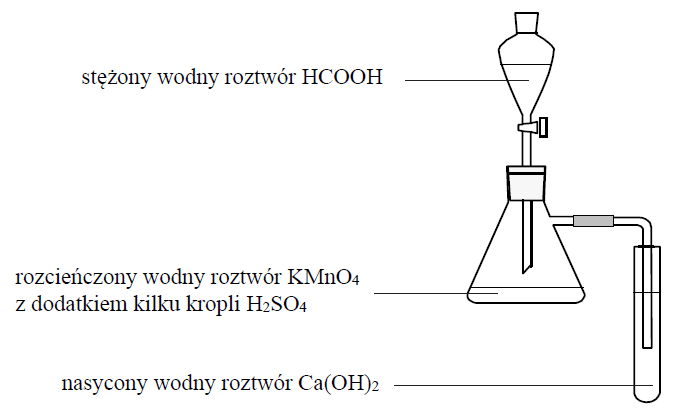
Po delikatnym ogrzaniu kolby z mieszaniną reakcyjną zaobserwowano odbarwianie roztworu w kolbie oraz powstanie białego osadu w probówce.
Uzupełnij poniższy zapis, tak aby przedstawiał on w formie jonowej skróconej równanie reakcji, która zaszła w kolbie podczas przeprowadzonego doświadczenia. Oceń, czy gdyby do opisanego doświadczenia użyto kwasu etanowego zamiast kwasu metanowego, również zaobserwowano by odbarwienie roztworu w kolbie oraz powstanie osadu w probówce. Uzasadnij swoje stanowisko. Równanie reakcji: Ocena wraz z uzasadnieniem:![]()
Określenie z uzasadnieniem czy kwas winowy występuje w postaci czterech stereoizomerów. Zadanie 33.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Poniżej przedstawiono wzór kwasu winowego:
HOOC–CH(OH)–CH(OH)–COOH
Przeanalizuj budowę cząsteczki kwasu winowego ze względu na możliwość wystąpienia stereoizomerii i odpowiedz na poniższe pytanie. Wpisz TAK albo NIE do tabeli i podaj uzasadnienie. Uzasadnienie:
Rysowanie dwóch stereoizomerów kwasu winowego będących diastereoizomerami. Zadanie 33.2. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Poniżej przedstawiono wzór kwasu winowego:
HOOC–CH(OH)–CH(OH)–COOH
Uzupełnij poniższe schematy – utwórz wzory w projekcji Fischera dwóch stereoizomerów kwasu winowego będących diastereoizomerami.
Zapis wzoru półstrukturalnego produktu reakcji kwasu winowego z nadmiarem metanolu. Zadanie 34. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Poniżej przedstawiono wzór kwasu winowego:
HOOC–CH(OH)–CH(OH)–COOH
Napisz wzór półstrukturalny (grupowy) organicznego produktu reakcji kwasu winowego z metanolem użytym w nadmiarze w środowisku stężonego kwasu siarkowego(VI).
Wybór właściwego odczynnika w celu przeprowadzenia doświadczenia chemicznego. Zadanie 35.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Wykonano doświadczenie, w którym do dwóch probówek z tym samym odczynnikiem wprowadzono wodne roztwory dwóch związków chemicznych. Do probówki I wprowadzono wodny roztwór winianu disodu (NaOOC–CH(OH)–CH(OH)–COONa), a do probówki II – wodny roztwór etanianu (octanu) sodu (CH3COONa). W warunkach doświadczenia obydwa wodne roztwory były bezbarwnymi cieczami.
Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że roztwór winianu disodu wprowadzono do probówki I, a roztwór octanu sodu – do probówki II.
Uzupełnij schemat doświadczenia. Podkreśl nazwę odczynnika, który – po dodaniu do niego roztworów opisanych związków i wymieszaniu zawartości probówek – umożliwi zaobserwowanie różnic w przebiegu doświadczenia z udziałem winianu disodu i octanu sodu.
Opis zmian na podstawie przeprowadzonego doświadczenia potwierdzających obecność określonych substancji w probówkach. Zadanie 35.2. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Wykonano doświadczenie, w którym do dwóch probówek z tym samym odczynnikiem wprowadzono wodne roztwory dwóch związków chemicznych. Do probówki I wprowadzono wodny roztwór winianu disodu (NaOOC–CH(OH)–CH(OH)–COONa), a do probówki II – wodny roztwór etanianu (octanu) sodu (CH3COONa). W warunkach doświadczenia obydwa wodne roztwory były bezbarwnymi cieczami.
Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że roztwór winianu disodu wprowadzono do probówki I, a roztwór octanu sodu – do probówki II.
Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia, pozwalające na potwierdzenie, że do probówki I wprowadzono roztwór winianu disodu, a do probówki II – roztwór octanu sodu. Probówka I: Probówka II:
Określenie nazw związków chemicznych zidentyfikowanych w kolejnych etapach doświadczenia. Zadanie 36.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
W trzech probówkach (I, II i III) znajdowały się wodne roztwory:
mocznika (CO(NH2)2), chlorku amonu (NH4Cl) i acetamidu (CH3CONH2).
W celu ich identyfikacji przeprowadzono dwie serie doświadczeń. W pierwszej serii doświadczeń do każdej probówki zanurzono żółty uniwersalny papierek wskaźnikowy. Zmianę barwy wskaźnika zaobserwowano tylko w probówce III. W drugiej serii doświadczeń do probówek I i II dodano wodny roztwór wodorotlenku sodu i ogrzano zawartości obu naczyń. U wylotu obu probówek wyczuwalny był ten sam charakterystyczny zapach. Następnie do probówek I i II dodano wodny roztwór azotanu(V) baru. Pojawienie się białego osadu zaobserwowano tylko w probówce I.
Podaj nazwy związków, które zidentyfikowano podczas przeprowadzonych doświadczeń. Probówka I: Probówka II: Probówka III:
Określenie odczynu roztworu wraz z uzasadnieniem równaniem procesu chemicznego. Zadanie 36.2. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
W trzech probówkach (I, II i III) znajdowały się wodne roztwory:
mocznika (CO(NH2)2), chlorku amonu (NH4Cl) i acetamidu (CH3CONH2).
W celu ich identyfikacji przeprowadzono dwie serie doświadczeń. W pierwszej serii doświadczeń do każdej probówki zanurzono żółty uniwersalny papierek wskaźnikowy. Zmianę barwy wskaźnika zaobserwowano tylko w probówce III. W drugiej serii doświadczeń do probówek I i II dodano wodny roztwór wodorotlenku sodu i ogrzano zawartości obu naczyń. U wylotu obu probówek wyczuwalny był ten sam charakterystyczny zapach. Następnie do probówek I i II dodano wodny roztwór azotanu(V) baru. Pojawienie się białego osadu zaobserwowano tylko w probówce I.
Określ odczyn roztworu znajdującego się w probówce III i napisz w formie jonowej skróconej równanie reakcji, które potwierdzi wskazany odczyn. Odczyn roztworu: Równanie reakcji:
Zapis wzoru substancji o charakterystycznym zapachu oraz zapis równania reakcji chemicznej. Zadanie 36.3. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
W trzech probówkach (I, II i III) znajdowały się wodne roztwory:
mocznika (CO(NH2)2), chlorku amonu (NH4Cl) i acetamidu (CH3CONH2).
W celu ich identyfikacji przeprowadzono dwie serie doświadczeń. W pierwszej serii doświadczeń do każdej probówki zanurzono żółty uniwersalny papierek wskaźnikowy. Zmianę barwy wskaźnika zaobserwowano tylko w probówce III. W drugiej serii doświadczeń do probówek I i II dodano wodny roztwór wodorotlenku sodu i ogrzano zawartości obu naczyń. U wylotu obu probówek wyczuwalny był ten sam charakterystyczny zapach. Następnie do probówek I i II dodano wodny roztwór azotanu(V) baru. Pojawienie się białego osadu zaobserwowano tylko w probówce I.
Napisz wzór substancji, której charakterystyczny zapach był wyczuwalny u wylotu probówek I i II, oraz napisz w formie jonowej skróconej równanie reakcji, w wyniku której w probówce I powstał biały osad. Wzór substancji: Równanie reakcji: