Zapis równań dwóch procesów chemicznych. Zadanie 13. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie:
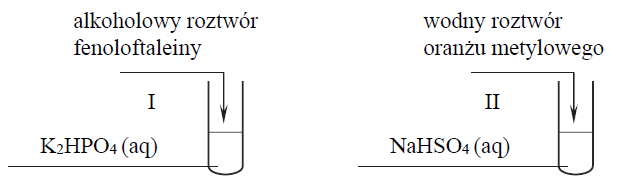
Podczas przeprowadzonego doświadczenia zaobserwowano, że zawartość probówki I przybrała zabarwienie malinowe, a zawartość probówki II – czerwone.
Uzupełnij poniższe zapisy, tak aby otrzymać w formie jonowej skróconej równania procesów zachodzących w probówkach I oraz II i decydujących o odczynie wodnych roztworów soli.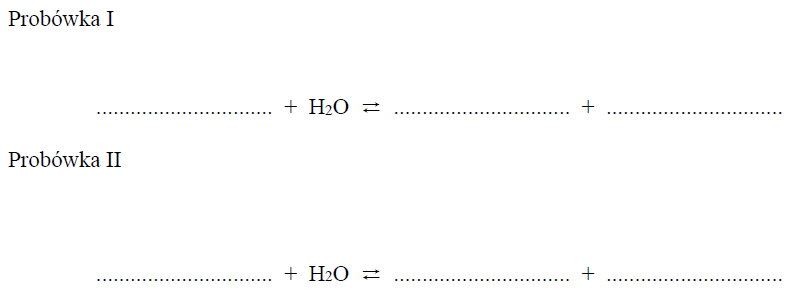
Porównanie pH roztworów o takim samym stężeniu molowym. Zadanie 14. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
W temperaturze T przygotowano wodne roztwory sześciu elektrolitów: NaBr, NH4NO3, HCl, HCOOH, NaClO, NaClO4 o jednakowym stężeniu molowym równym 0,1 mol · dm–3.
HCOOH, NaClO, NaClO4 o jednakowym stężeniu molowym równym 0,1 mol · dm–3. Porównaj pH tych roztworów. Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej. wyższe niż równe niższe niż pH wodnego roztworu NaBr jest pH wodnego roztworu NH4NO3. pH wodnego roztworu HCl jest pH wodnego roztworu HCOOH. pH wodnego roztworu NaClO jest pH wodnego roztworu NaClO4.
Obliczanie masy miedzi w stopie z cynkiem poddanym reakcji z kwasem solnym. Zadanie 15. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Na próbkę stopu miedzi z cynkiem o masie 4,00 g podziałano 200 cm3 kwasu solnego o stężeniu 0,800 mol·dm–3. Przebiegła wtedy reakcja opisana równaniem:
Me + 2H3O+ → Me2+ + H2 + 2H2O
Roztwór otrzymany po reakcji rozcieńczono wodą do objętości 250 cm3. Stężenie jonów wodorowych w tym roztworze było równe 0,400 mol·dm–3.
Oblicz, ile gramów miedzi znajdowało się w opisanej próbce stopu. Wynik końcowy zaokrąglij do drugiego miejsca po przecinku.
Ocena poprawności zdań dotyczących doświadczeń z udziałem blaszek oraz wodnych roztworów soli. Zadanie 16. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego celem było porównanie aktywności trzech metali oznaczonych umownie literami A, X i Z. Przebieg doświadczenia zilustrowano poniższym schematem.
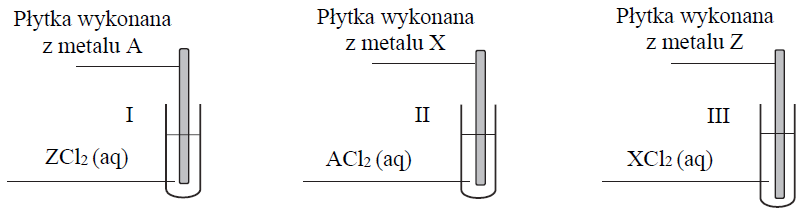
Zmiany zaobserwowane podczas doświadczenia pozwoliły stwierdzić, że aktywność użytych metali rośnie w szeregu A, Z, X.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Spośród metali A, X, Z najsilniejszym reduktorem jest metal X. 2. Spośród jonów A2+ , X2+ , Z2+ najsilniejszym utleniaczem jest jon A2+. 3. Podczas przeprowadzonego doświadczenia tylko w probówce III nie zaobserwowano objawów reakcji.
Wskazanie najwolniejszego etapu w procesie halogenowania alkanów. Zadanie 17. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Poniżej podano ciąg przemian chemicznych:
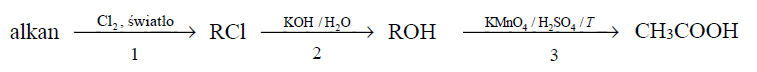
gdzie R – grupa alkilowa.
Halogenowanie alkanów (przemiana oznaczona na schemacie numerem 1) w obecności światła przebiega przez następujące etapy:
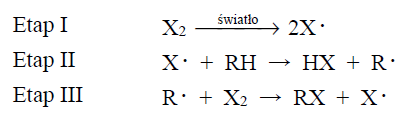
Szybkość tworzenia się halogenku alkilu zależy od szybkości, z jaką powstaje rodnik alkilowy.
Podkreśl numer najwolniejszego etapu reakcji oznaczonej na schemacie numerem 1. Etap I Etap II Etap III
Określanie typów oraz mechanizmów reakcji chemicznych. Zadanie 18. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Poniżej podano ciąg przemian chemicznych:
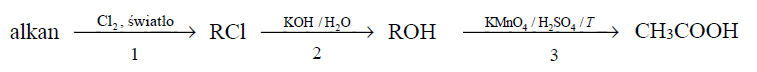
gdzie R – grupa alkilowa.
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji oznaczonych na schemacie numerami 1 i 2. Uzupełnij tabelę.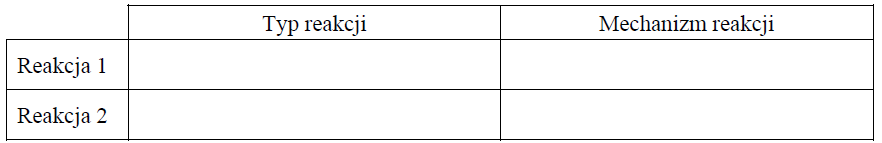
Wskazanie barwy mieszaniny przed i po reakcji chemicznej. Zadanie 19. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Poniżej podano ciąg przemian chemicznych:
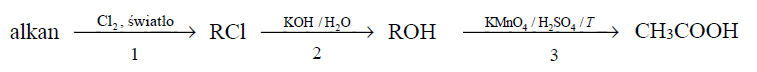
gdzie R – grupa alkilowa.
Przeprowadzono doświadczenie, podczas którego przebiegła reakcja oznaczona na schemacie numerem 3.
Uzupełnij tabelę – wpisz barwy mieszaniny reakcyjnej przed reakcją i po reakcji, jakie można było zaobserwować w czasie tego doświadczenia.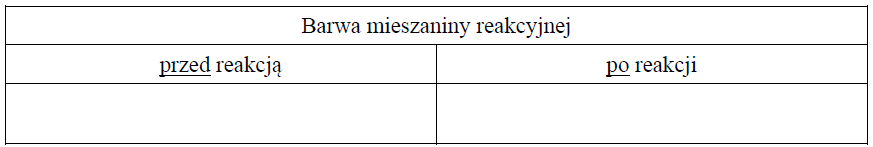
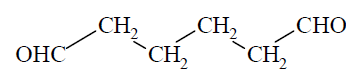
Wskazanie nazw systematycznych produktów ozonolizy alkenu. Zadanie 20. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Ozon, odczynnik utleniający, ma zdolność rozszczepiania wiązania podwójnego. W niskiej temperaturze ozon szybko przyłącza się do wiązań podwójnych, w wyniku czego daje cykliczne produkty pośrednie, które ulegają przegrupowaniu do ozonków. Ostatecznym efektem reakcji ozonolizy jest rozszczepienie wiązania podwójnego. Każdy z dwóch atomów węgla, pierwotnie związanych wiązaniem podwójnym, w produktach rozszczepienia jest połączony podwójnym wiązaniem z atomem tlenu.
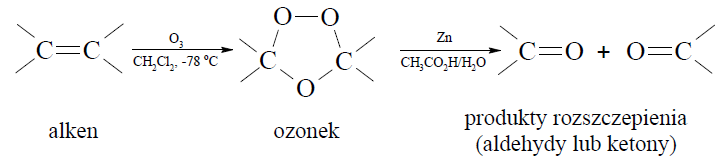
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Poniżej przedstawiono wzór półstrukturalny (grupowy) węglowodoru, który poddano ozonolizie.
![]()
Podaj nazwy systematyczne końcowych produktów reakcji ozonolizy, której poddano ten węglowodór.
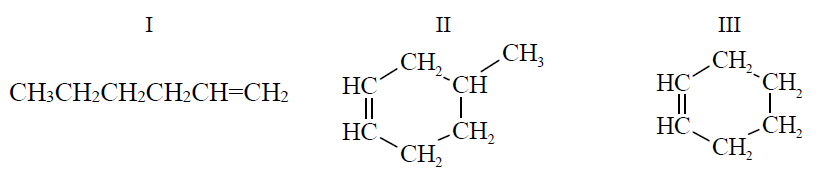
Określenie wzorów grupowych alkenów oraz wyjaśnienie, dlaczego jeden z nich nie występuje w postaci izomerów cis-trans. Zadanie 22. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Spośród izomerycznych alkenów o wzorze sumarycznym C6H12 tylko alkeny A i B utworzyły w reakcji z HCl (jako produkt główny) halogenek alkilowy o wzorze:
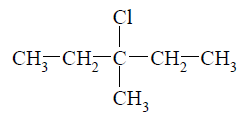
O tych alkenach wiadomo także, że alken A występuje w postaci izomerów geometrycznych cis–trans, a alken B – nie.
Napisz wzory półstrukturalne (grupowe) alkenów A i B. Wyjaśnij, dlaczego alken B nie występuje w postaci izomerów geometrycznych cis–trans. Wzór alkenu A: Wzór alkenu B: Wyjaśnienie:
Zapis wzoru produktu reakcji alkinu z amidkiem sodu oraz związku chemicznego, który nie reaguje. Zadanie 23. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Alkiny o wzorze ogólnym R−C≡CH (tzw. alkiny terminalne) reagują z amidkiem sodu (NaNH2), w wyniku czego tworzą acetylenki sodu (R−C≡CNa) zgodnie z równaniem:
R−C≡CH + NaNH2 → R−C≡C−Na+ + NH3
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Jeden z izomerycznych alkinów o wzorze sumarycznym C4H6, który umownie nazwano związkiem I, reaguje z amidkiem sodu. Drugi z izomerycznych alkinów, który umownie nazwano związkiem II, takiej reakcji nie ulega.
Uzupełnij poniższą tabelę. Napisz wzór półstrukturalny (grupowy) substancji, która jest organicznym produktem reakcji związku I z amidkiem sodu, oraz wzór półstrukturalny (grupowy) związku II.
Określanie, czy entalpia reakcji ma wartość dodatnią czy ujemną. Zadanie 24. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
W wysokiej temperaturze może zachodzić rozkład metanu na substancje proste zgodnie z równaniem:
CH4(g) ⇄ C(s) + 2H2(g)
Miarą wydajności tej reakcji jest równowagowy stopień przemiany metanu x, który wyraża się wzorem:
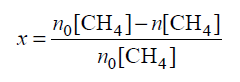
W tym wzorze no[CH4 ] oznacza początkową liczbę moli metanu, a n[CH4] – liczbę moli tego gazu pozostałego po ustaleniu się stanu równowagi. Poniżej przedstawiono zależność równowagowego stopnia przemiany metanu x od temperatury dla trzech wartości ciśnienia.
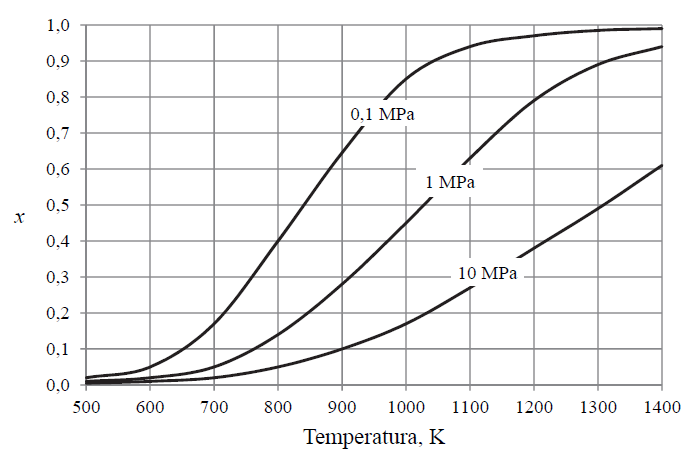
Na podstawie: P. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Określ, czy ΔH opisanej reakcji rozkładu metanu jest większa od zera, czy – mniejsza od zera. Odpowiedź uzasadnij.
Wyjaśnienie przyczyny spadku wydajności reakcji ze wzrostem ciśnienia. Zadanie 25. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
W wysokiej temperaturze może zachodzić rozkład metanu na substancje proste zgodnie z równaniem:
CH4(g) ⇄ C(s) + 2H2(g)
Miarą wydajności tej reakcji jest równowagowy stopień przemiany metanu x, który wyraża się wzorem:
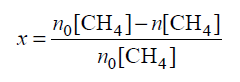
W tym wzorze no[CH4 ] oznacza początkową liczbę moli metanu, a n[CH4] – liczbę moli tego gazu pozostałego po ustaleniu się stanu równowagi. Poniżej przedstawiono zależność równowagowego stopnia przemiany metanu x od temperatury dla trzech wartości ciśnienia.

Na podstawie: P. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Wyjaśnij, dlaczego wydajność opisanej reakcji maleje ze wzrostem ciśnienia.
Ustalanie wzoru grupowego chloropochodnej węglowodoru na podstawie składu ilościowego. Zadanie 26. Arkusz CKE chemia maj 2017 rozszerzony (2 punkty)
Podczas ogrzewania próbki monochloropochodnej pewnego nasyconego węglowodoru o budowie łańcuchowej z nadmiarem wodnego roztworu wodorotlenku sodu przebiegła reakcja zilustrowana schematem:
CxHyCl + NaOH → CxHyOH + NaCl
Do otrzymanej mieszaniny poreakcyjnej dodano najpierw wodny roztwór kwasu azotowego(V) w celu zobojętnienia, a następnie – nadmiar wodnego roztworu azotanu(V) srebra. W wyniku reakcji opisanej równaniem:
Ag+ + Cl− ⎯→ AgCl↓
wytrącił się osad, który odsączono i wysuszono. Masa próbki monochloropochodnej była równa 0,314 g, a w wyniku opisanych przemian otrzymano 0,574 g stałego chlorku srebra.
Wykonaj obliczenia i zaproponuj jeden wzór półstrukturalny (grupowy) chloropochodnej tego węglowodoru.
Zapis połówkowych równań reakcji jonów bromkowych z jonami bromianowymi(V) bez stosowania stopni utlenienia. Zadanie 27.1. Arkusz CKE chemia maj 2017 rozszerzony (1 punkt)
Oznaczanie zawartości fenolu w ściekach przemysłowych możne przebiegać w kilku etapach opisanych poniżej.
Etap I: Otrzymywanie bromu.
Etap II: Bromowanie fenolu.
Etap III: Wydzielanie jodu.
Etap IV: Miareczkowanie jodu.
Podczas etapu I (oznaczania zawartości fenolu) zachodzi reakcja jonów bromkowych z jonami bromianowymi(V) – BrO3– w roztworze o odczynie kwasowym. Produktami tej przemiany są brom i woda.
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas opisanego procesu (etapu I). Uwzględnij środowisko reakcji. Równanie reakcji redukcji: Równanie reakcji utleniania: