Obliczanie czasu trwania elektrolizy. Zadanie 28. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Elektroliza wodnego roztworu chlorku sodu na elektrodach grafitowych przebiega zgodnie z równaniem:
![]()
Oblicz, ile sekund trwała elektroliza, jeśli otrzymano 10 cm3 wodoru (w przeliczeniu na warunki normalne), a natężenie prądu przepuszczanego przez elektrolizer wynosiło 1 A. Stała Faradaya F = 96500 C· mol–1. Wynik zaokrąglij do liczb całkowitych.
Zapis wzorów grupowych związków chemicznych na podstawie ciągu przemian. Zadanie 29. Arkusz CKE chemia maj 2014 rozszerzony (3 punkty)
Poniżej przedstawiono ciąg przemian prowadzących do powstania cykloheksenu.
![]()
Uzupełnij tabelę, wpisując wzory półstrukturalne (grupowe) lub uproszczone związków organicznych oznaczonych na schemacie literami A i B oraz wzór cykloheksenu.
Określenie efekty cieplnego procesu skraplania benzenu. Zadanie 30. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Benzen wrze pod ciśnieniem 1000 hPa (1 bar) w temperaturze 352,2 K. Standardowa molowa entalpia parowania benzenu w temperaturze przemiany wynosi 30,8 kJ·mol–1.
P.W. Atkins, Chemia fizyczna, Warszawa 2001.
Na podstawie powyższej informacji oceń, czy skraplanie benzenu w temperaturze 352,2 K jest przemianą egzo- czy endotermiczną.
Zapis równania kinetycznego reakcji estryfikacji. Zadanie 31. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
![]()
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
Napisz równanie kinetyczne opisanej reakcji estryfikacji.
Obliczanie liczby moli kwasu octowego w stanie równowagi. Zadanie 32. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
![]()
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
W naczyniu o objętości V zmieszano w temperaturze 25 °C 1 mol kwasu etanowego i 1 mol etanolu. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI).
Oblicz, ile moli kwasu etanowego pozostało w mieszaninie po ustaleniu się stanu równowagi.
Wskazanie czynności skutkujących zwiększeniem wydajności reakcji estryfikacji. Zadanie 33. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
![]()
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
Podkreśl wszystkie wymienione poniżej działania, które spowodują zwiększenie wydajności opisanej reakcji estryfikacji w temperaturze 25 °C. dodanie etanolu dodanie wody dodanie katalizatora dodanie obojętnej wobec reagentów substancji higroskopijnej.
Zapis wzorów grupowych pochodnych alkoholu monohydroksylowego. Zadanie 34. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Poniżej przedstawiono schemat przemian, jakim ulegają pochodne węglowodorów. Symbolami R i R1 oznaczono grupy alkilowe.
![]()
Wypełnij tabelę, wpisując ogólne wzory pochodnych związku RCH2OH, które na schemacie oznaczono numerami I–IV.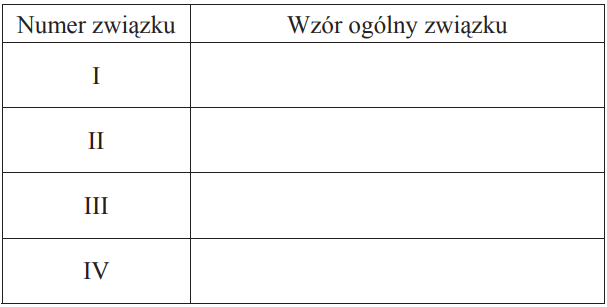
Wskazanie liczby niecyklicznych produktów kondensacji alaniny z kwasem asparaginowym. Zadanie 35. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.
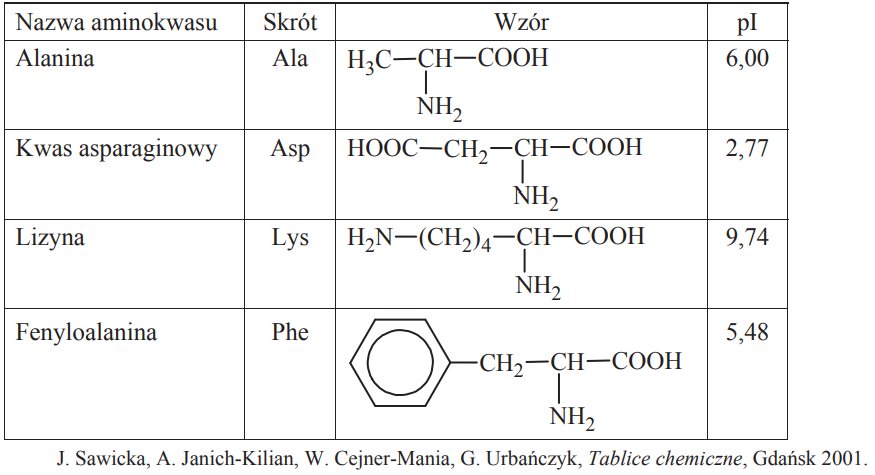
Określ liczbę wszystkich możliwych organicznych niecyklicznych produktów kondensacji jednej cząsteczki alaniny z jedną cząsteczką kwasu asparaginowego.
Rysowanie formy fenyloalaniny dominującej w roztworze o pH = 5,48. Zadanie 36. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.

Napisz wzór tej formy fenyloalaniny, której stężenie jest największe w roztworze o pH równym 5,48.
Projektowanie doświadczenia polegającego na odróżnieniu alaniny od fenyloalaniny. Zadanie 37ab. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.

Zaplanuj doświadczenie, którego przebieg pozwoli na odróżnienie alaniny od fenyloalaniny. a) Uzupełnij poniższy schemat doświadczenia, wpisując nazwę odczynnika, po którego dodaniu do obu probówek i ogrzaniu ich zawartości możliwe będzie zaobserwowanie różnic w przebiegu doświadczenia z udziałem alaniny i fenyloalaniny. Odczynnik wybierz spośród następujących: − wodny roztwór chlorku żelaza(III) − świeżo strącony wodorotlenek miedzi(II) − wodny roztwór wodorotlenku sodu z fenoloftaleiną − rozcieńczony kwas solny z oranżem metylowym − mieszanina stężonych kwasów: azotowego(V) i siarkowego(VI) Wybrany odczynnik: b) Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia, pozwalające na odróżnienie alaniny od fenyloalaniny. Probówka I: Probówka II: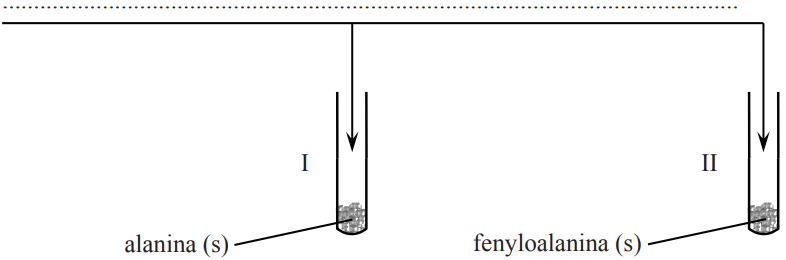
Wskazanie przyczyny różnicy wartości punktu izoelektrycznego kwasu asparaginowego i lizyny. Zadanie 38. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.

Wskaż przyczynę różnicy wartości punktu izoelektrycznego kwasu asparaginowego i lizyny.
Ocena poprawności zdań dotyczących sacharozy oraz maltozy. Zadanie 39. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Poniżej przedstawiono wzory (w projekcji Hawortha) dwóch disacharydów: maltozy i sacharozy.
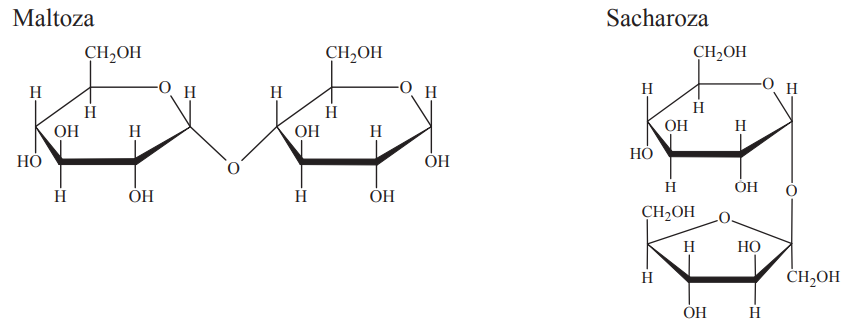
W oddzielnych probówkach przygotowano wodne roztwory maltozy oraz sacharozy i dodano do nich świeżo strącony wodorotlenek miedzi(II). Następnie zawartość obu probówek zalkalizowano i ogrzano. W warunkach doświadczenia w probówce zawierającej roztwór maltozy zaobserwowano powstanie ceglastego osadu, natomiast w probówce z roztworem sacharozy wytrącił się czarny osad.
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe. 1. W reakcji z maltozą wodorotlenek miedzi(II) uległ redukcji do Cu2O, o czym świadczy powstanie ceglastego osadu. 2. Czarny osad powstający w probówce z roztworem sacharozy to CuO, który jest produktem rozkładu wodorotlenku miedzi(II). 3. Sacharoza nie wykazała właściwości redukujących, ponieważ w jej cząsteczkach wiązanie glikozydowe łączy pierwszy atom węgla reszty glukozy z drugim atomem węgla reszty fruktozy.