Wskazanie wielkości, których wzrost wskazują strzałki. Zadanie 1. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Na rysunku przedstawiono schemat układu okresowego pierwiastków (bez lantanowców i aktynowców), na którym umieszczono strzałki A i B odpowiadające kierunkom zmian
wybranych wielkości charakteryzujących pierwiastki chemiczne.
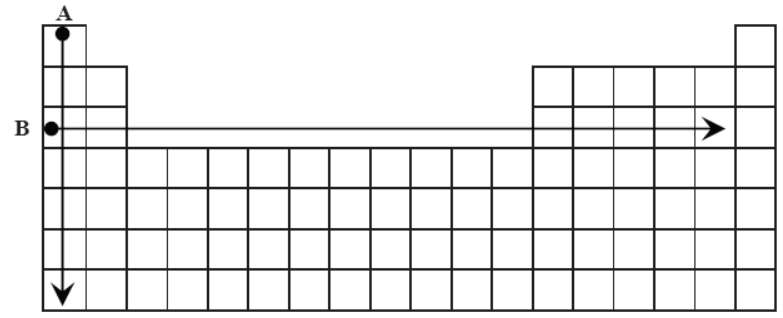
Podkreśl wszystkie wymienione poniżej wielkości, których wzrost wskazują strzałki oznaczone literami A i B. 1. Dla pierwiastków 1. grupy strzałka A wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego promienia jonowego. 2. Dla pierwiastków grup 1.–2. i 13.–17. okresu III strzałka B wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego charakteru metalicznego.
Ocena poprawności zdań dotyczących trzech pierwiastków chemicznych. Zadanie 2. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz III.
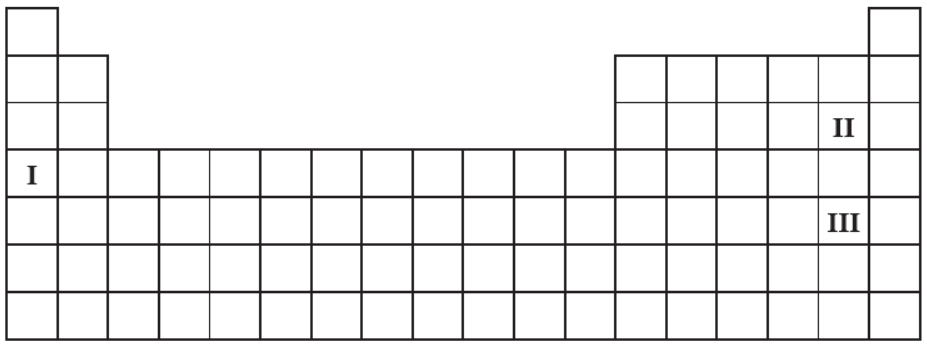
Wypełnij tabelę, wpisując literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa. 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje stopień utlenienia równy – I. 2. Atomy pierwiastka II mają silniejszą tendencję do przyłączania elektronu niż atomy pierwiastka III. W konsekwencji pierwiastek II jest silniejszym utleniaczem niż pierwiastek III. 3. Wodorki pierwiastków II oraz III, rozpuszczając się w wodzie, ulegają dysocjacji jonowej. Stała dysocjacji wodorku pierwiastka II jest większa od stałej dysocjacji wodorku pierwiastka III.
Wskazanie nazwy wielkości fizycznej. Zadanie 3a. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Na poniższym wykresie przedstawiono zależność pewnej makroskopowej wielkości charakteryzującej pierwiastki chemiczne w funkcji ich liczby atomowej Z.
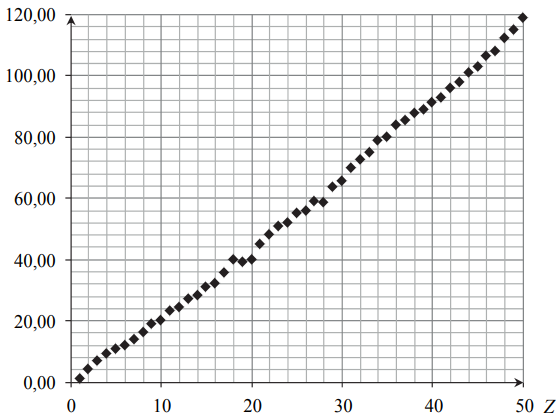
Opisz oś pionową wykresu, podając nazwę tej wielkości oraz jednostkę, w jakiej jest ona wyrażana.
Opis osi pionowej:
Wybór właściwej grupy pierwiastków. Zadanie 3b. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Pierwsza energia jonizacji E1 to najmniejsza energia potrzebna do oddzielenia pierwszego (o najwyższej energii) elektronu od atomu. Poniższy wykres przedstawia zależność pierwszej energii jonizacji atomów pierwiastków z czterech pierwszych okresów układu okresowego od liczby atomowej Z tych pierwiastków.
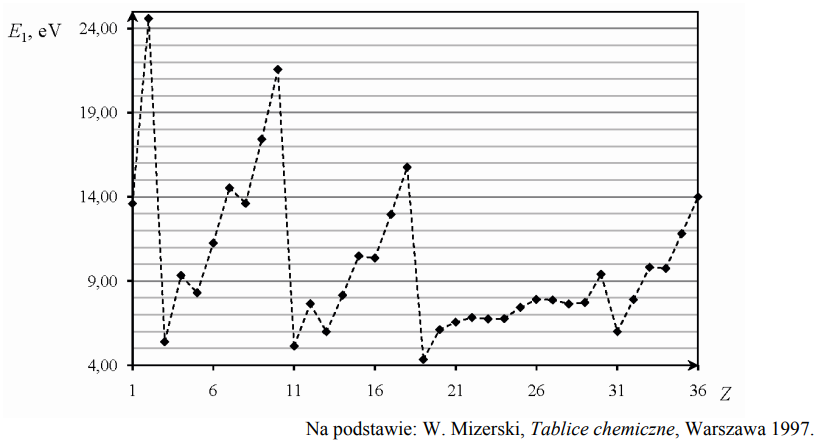
Uzupełnij zdanie. Wybierz i podkreśl numer grupy pierwiastków spośród podanych w nawiasie. W danym okresie układu okresowego największą wartość pierwszej energii jonizacji E1 mają pierwiastki (pierwszej / trzeciej / siedemnastej / osiemnastej) grupy.
Obliczanie masy atomowej galu. Zadanie 4. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów galu występujących w przyrodzie.
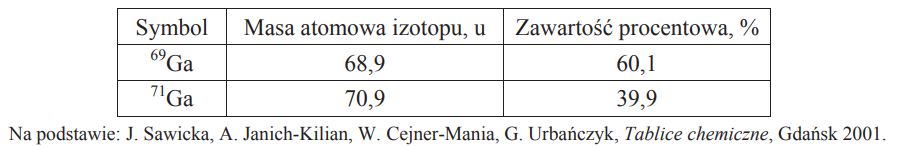
Oblicz masę atomową galu. Wynik zaokrąglij do pierwszego miejsca po przecinku.
Zapis równania reakcji jądrowej. Zadanie 5. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Radioaktywny izotop galu o liczbie masowej równej 67 jest stosowany w medycynie nuklearnej. Otrzymuje się go w reakcji zachodzącej podczas bombardowania protonami jąder izotopu cynku o liczbie masowej równej 68.
Napisz równanie opisanego procesu, uzupełniając poniższy schemat.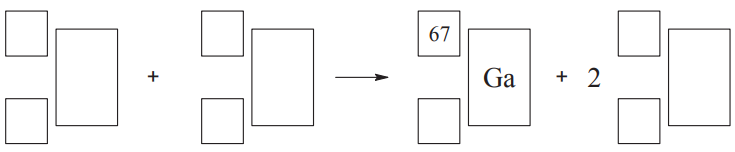
Wybór poprawnych określeń dotyczących niesparowanego elektronu w atomie galu. Zadanie 6. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
W stanie podstawowym atom galu ma jeden niesparowany elektron.
Uzupełnij zdania. Wybierz i podkreśl symbol typu podpowłoki oraz wartość głównej i pobocznej liczby kwantowej spośród podanych w nawiasach. Niesparowany elektron atomu galu w stanie podstawowym należy do podpowłoki typu (s / p / d). Główna liczba kwantowa n opisująca stan tego elektronu wynosi (2 / 3 / 4), a poboczna liczba kwantowa l jest równa (0 / 1 / 2 / 3).
Zapis równań reakcji galu z roztworem kwasu i roztworem zasady. Zadanie 7. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Gal jest metalem, który roztwarza się w mocnych kwasach oraz mocnych zasadach. W reakcjach tych tworzy sole, przechodząc na stopień utlenienia III. Drugi produkt tych reakcji jest taki sam jak w reakcjach glinu z mocnymi kwasami i zasadami. Poniżej przedstawiono schemat reakcji galu z mocnymi kwasami i zasadami.
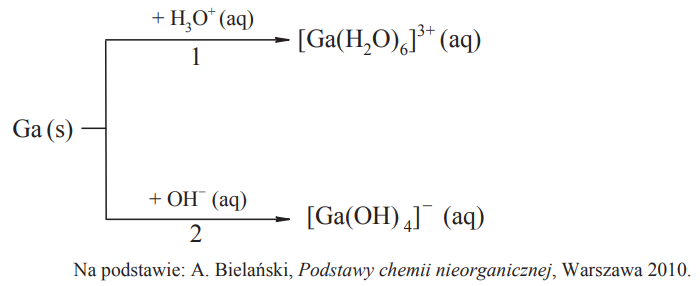
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2. 1: 2:
Obliczanie stężenia molowego kwasu w określonym momencie reakcji. Zadanie 8. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Po wrzuceniu 0,720 g magnezu do 0,150 dm3 kwasu solnego o stężeniu 0,120 mol·dm–3 zaszła reakcja opisana równaniem:
Mg + 2H3O+ → Mg2+ + H2 + 2H2O
Oblicz stężenie molowe kwasu solnego w momencie, gdy przereagowało 20% masy magnezu. W obliczeniach przyjmij, że objętość roztworu się nie zmienia. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Rysowanie kreskowego wzoru elektronowego kwasu borowego oraz wyjaśnienie, dlaczego jest akceptorem jonów wodorotlenkowych. Zadanie 9. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Kwas ortoborowy H3BO3 jest bardzo słabym wieloprotonowym kwasem, który w roztworach wodnych działa nie jako donor protonów, lecz jako akceptor jonów wodorotlenkowych, reagując z wodą zgodnie z równaniem:
H3BO3 + 2H2O ⇄ H3O+ + [B(OH)4]–
Stała równowagi tej reakcji jest równa 5,8·10–10 . W obecności środków odciągających wodę, np. stężonego H2SO4, kwas ortoborowy tworzy z alkoholami estry.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Narysuj wzór elektronowy cząsteczki kwasu ortoborowego, oznaczając kreskami wiązania oraz wolne pary elektronowe. Wyjaśnij, dlaczego kwas borowy jest akceptorem jonów wodorotlenkowych.
Wskazanie nazwy tworzącego się wiązania chemicznego. Zadanie 10. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Kwas ortoborowy H3BO3 jest bardzo słabym wieloprotonowym kwasem, który w roztworach wodnych działa nie jako donor protonów, lecz jako akceptor jonów wodorotlenkowych, reagując z wodą zgodnie z równaniem:
H3BO3 + 2H2O ⇄ H3O+ + [B(OH)4]–
Stała równowagi tej reakcji jest równa 5,8·10–10 . W obecności środków odciągających wodę, np. stężonego H2SO4, kwas ortoborowy tworzy z alkoholami estry.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Nazwij typ wiązania (ze względu na sposób jego powstawania), jakie tworzy się między atomem boru w cząsteczce kwasu ortoborowego i anionem wodorotlenkowym.
Zapis równania reakcji kwasu ortoborowego z metanolem. Zadanie 12. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Kwas ortoborowy H3BO3 jest bardzo słabym wieloprotonowym kwasem, który w roztworach wodnych działa nie jako donor protonów, lecz jako akceptor jonów wodorotlenkowych, reagując z wodą zgodnie z równaniem:
H3BO3 + 2H2O ⇄ H3O+ + [B(OH)4]–
Stała równowagi tej reakcji jest równa 5,8·10–10 . W obecności środków odciągających wodę, np. stężonego H2SO4, kwas ortoborowy tworzy z alkoholami estry.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz, posługując się wzorami półstrukturalnymi (grupowymi) związków organicznych, równanie reakcji kwasu ortoborowego z metanolem, w której stosunek molowy kwasu do alkoholu jest równy 1 : 3.
Obliczanie standardowej entalpii uwodornienia etenu. Zadanie 13. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
W tabeli podano wartości standardowej molowej entalpii trzech reakcji.
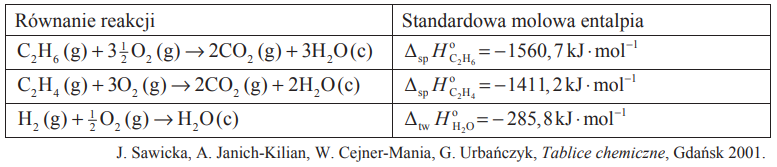
Na podstawie powyższych danych oblicz standardową molową entalpię reakcji uwodornienia etenu ΔHox, która zachodzi zgodnie z równaniem: C2H4(g) + H2(g) → C2H6(g) Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Wskazanie nazwy systematycznej kwasu izocytrynowego. Zadanie 14. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Kwas cytrynowy (kwas 2-hydroksypropano-1,2,3-trikarboksylowy) o składzie C6H8O7 spełnia ważną funkcję w metabolizmie organizmów jako produkt przejściowy cyklu Krebsa, w którym ulega izomeryzacji do kwasu izocytrynowego o następującym wzorze:
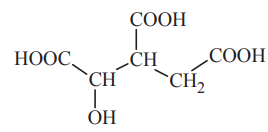
Podaj nazwę systematyczną kwasu izocytrynowego.