Wskazanie roli jaką pełni w reakcji nadtlenek wodoru. Zadanie 9c. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Poniżej przedstawiony jest schemat reakcji:
![]()
Napisz, jaką funkcję (utleniacza czy reduktora) pełni w tej reakcji nadtlenek wodoru.
Obliczanie stałej równowagi reakcji chemicznej. Zadanie 10. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W reaktorze o objętości 1 dm3 przebiega w stałej temperaturze T reakcja opisana schematem
A(g) + B(g) ⇄ 2C(g) + D(g)
Po zmieszaniu substratów A i B w stosunku molowym 1 : 1 zainicjowano reakcję. W mieszaninie równowagowej stężenie substancji D było równe 2 mol·dm–3 , a stosunek stężeń molowych reagentów B i C wynosił [B]:[C] = 1 : 2,3.
Oblicz stałą równowagi tej reakcji w temperaturze T. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zapis równania reakcji chemicznej, jaka przebiegła jako pierwsza. Zadanie 11. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W 1 dm3 pewnego wodnego roztworu znajdowało się 1,0·10–10 mola jonów Cl–, 1,0·10–10 mola jonów I– oraz jony Na+. Do roztworu wprowadzono kroplę roztworu AgNO3 zawierającą 1,0·10–5 mola tej soli. Iloczyny rozpuszczalności AgCl i AgI w temperaturze T, w której przeprowadzono doświadczenie, wynoszą:
KSO = [Ag+ ]·[Cl–] = 1,8·10–10 i KSO = [Ag+]·[I–] = 8,5·10–17
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002.
Napisz w formie jonowej skróconej równanie reakcji, która zaszła jako pierwsza podczas opisanego doświadczenia.
Ocena, czy może istnieć roztwór o podanej wartości iloczynu stężeń molowych kationów srebra i anionów chlorkowych. Zadanie 12. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W 1 dm3 pewnego wodnego roztworu znajdowało się 1,0·10–10 mola jonów Cl–, 1,0·10–10 mola jonów I– oraz jony Na+. Do roztworu wprowadzono kroplę roztworu AgNO3 zawierającą 1,0·10–5 mola tej soli. Iloczyny rozpuszczalności AgCl i AgI w temperaturze T, w której przeprowadzono doświadczenie, wynoszą:
KSO = [Ag+ ]·[Cl–] = 1,8·10–10 i KSO = [Ag+]·[I–] = 8,5·10–17
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002.
Oceń, czy w temperaturze T może istnieć roztwór, w którym iloczyn stężeń molowych kationów srebra i anionów chlorkowych wynosiłby 2·10–5. Uzasadnij swoje stanowisko.
Zapis równania reakcji tworzenia jonu kompleksowego srebra. Zadanie 13. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W 1 dm3 pewnego wodnego roztworu znajdowało się 1,0·10–10 mola jonów Cl–, 1,0·10–10 mola jonów I– oraz jony Na+. Do roztworu wprowadzono kroplę roztworu AgNO3 zawierającą 1,0·10–5 mola tej soli. Iloczyny rozpuszczalności AgCl i AgI w temperaturze T, w której przeprowadzono doświadczenie, wynoszą:
KSO = [Ag+ ]·[Cl–] = 1,8·10–10 i KSO = [Ag+]·[I–] = 8,5·10–17
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002.
Do wodnego roztworu zawierającego aniony chlorkowe (Cl–) i cząsteczki amoniaku (NH3) wprowadzono roztwór zawierający kationy srebra (Ag+). Nie zaobserwowano jednak wytrącenia osadu, który świadczyłby o powstaniu chlorku srebra (AgCl). Wynika to z faktu, że dla jonów Ag+ reakcją uprzywilejowaną w stosunku do reakcji tworzenia AgCl jest reakcja tworzenia jonu kompleksowego o liczbie koordynacyjnej 2, w którym rolę ligandów pełnią cząsteczki amoniaku.
Napisz w formie jonowej równanie reakcji prowadzącej do powstania opisanego jonu kompleksowego.
Określenie odczynu roztworu uzyskanego po zmieszaniu roztworów kwasu i zasady. Zadanie 14. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Do 100 g wodnego roztworu NaOH o stężeniu 10% masowych dodano 100 g kwasu solnego o stężeniu 10% masowych.
Spośród podanych poniżej zależności wybierz i podkreśl tę, która jest prawdziwa dla otrzymanego roztworu. pH > 7 pH = 7 pH < 7
Obliczanie stężenia glukozy po częściowej hydrolizie maltozy. Zadanie 15. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
Przygotowano 200 gramów wodnego roztworu maltozy o stężeniu 25,65% masowych. Po częściowej hydrolizie maltozy zachodzącej zgodnie z równaniem:
![]()
sumaryczna liczba moli cukrów redukujących (glukozy i maltozy) w roztworze wynosiła 0,28 mola.
Oblicz stężenie glukozy, wyrażone w procentach masowych, w roztworze powstałym po częściowej hydrolizie maltozy. Wynik podaj z dokładnością do jednego miejsca po przecinku. W obliczeniach przyjmij przybliżone wartości mas molowych: MC12H22O11 = 342 g·mol–1, MC6H12O6 = 180 g·mol–1.
Zapis sumarycznego równania reakcji biegnącej w akumulatorze kwasowo-ołowiowym oraz obliczenie wartości SEM. Zadanie 16. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W poniższej tabeli przedstawiono równania reakcji elektrodowych oraz odpowiadające im wartości potencjałów standardowych dwóch półogniw redoks tworzących tzw. akumulator kwasowo-ołowiowy.
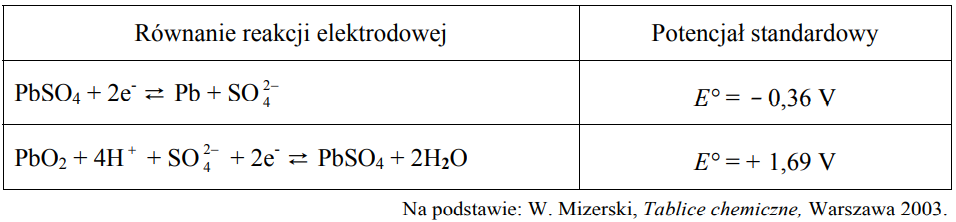
Korzystając z podanych informacji, napisz sumaryczne równanie reakcji, która zachodzi w pracującym akumulatorze kwasowo-ołowiowym, oraz oblicz siłę Równanie reakcji: SEM:
elektromotoryczną (SEM) tego ogniwa w warunkach standardowych.
Wskazanie rodzaju wiązania w wodorku litu oraz stopnia utlenienia wodoru. Zadanie 17a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W wyniku reakcji litowców z wodorem, prowadzonej w podwyższonej temperaturze, powstają wodorki o wzorze ogólnym MeH. Związki te są w temperaturze pokojowej ciałami stałymi, a po stopieniu przewodzą prąd elektryczny. Po wprowadzeniu ich do wody wydziela się wodór, a roztwór po dodaniu fenoloftaleiny przyjmuje malinowe zabarwienie.
Uwzględniając podany opis właściwości fizycznych wodorku litu i wiedząc, że jego temperatura topnienia wynosi 692 oC, określ rodzaj wiązania występującego w tym związku oraz podaj stopień utlenienia, jaki przyjmuje wodór w tym związku. Rodzaj wiązania: Stopień utlenienia wodoru:
Wskazanie rodzaju wiązania w wodorku litu oraz stopnia utlenienia wodoru. Zadanie 17b. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W wyniku reakcji litowców z wodorem, prowadzonej w podwyższonej temperaturze, powstają wodorki o wzorze ogólnym MeH. Związki te są w temperaturze pokojowej ciałami stałymi, a po stopieniu przewodzą prąd elektryczny. Po wprowadzeniu ich do wody wydziela się wodór, a roztwór po dodaniu fenoloftaleiny przyjmuje malinowe zabarwienie.
Napisz w formie cząsteczkowej równanie reakcji otrzymywania wodorku litu oraz równanie reakcji wodorku litu z wodą. Równanie reakcji otrzymywania wodorku litu: Równanie reakcji wodorku litu z wodą:
Zapis równań reakcji elektrodowych reakcji biegnących podczas elektrolizy stopionego wodorku litu. Zadanie 17c. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W wyniku reakcji litowców z wodorem, prowadzonej w podwyższonej temperaturze, powstają wodorki o wzorze ogólnym MeH. Związki te są w temperaturze pokojowej ciałami stałymi, a po stopieniu przewodzą prąd elektryczny. Po wprowadzeniu ich do wody wydziela się wodór, a roztwór po dodaniu fenoloftaleiny przyjmuje malinowe zabarwienie.
Napisz równania reakcji elektrodowych zachodzących w czasie elektrolizy stopionego wodorku litu, wiedząc, że na anodzie wydziela się wodór. Równanie reakcji katodowej: Równanie reakcji anodowej:
Wskazanie przybliżonej wartości energii dysocjacji wiązania C–H. Zadanie 18a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Energia dysocjacji wiązania C–H w alkanach (wyrażona w kJ·mol–1) to energia, jaką trzeba dostarczyć, aby przekształcić 1 mol alkanu w 1 mol atomów wodoru i 1 mol odpowiedniego rodnika organicznego. Przykłady takich procesów oraz odpowiadające im energie dysocjacji zestawiono w poniższej tabeli.
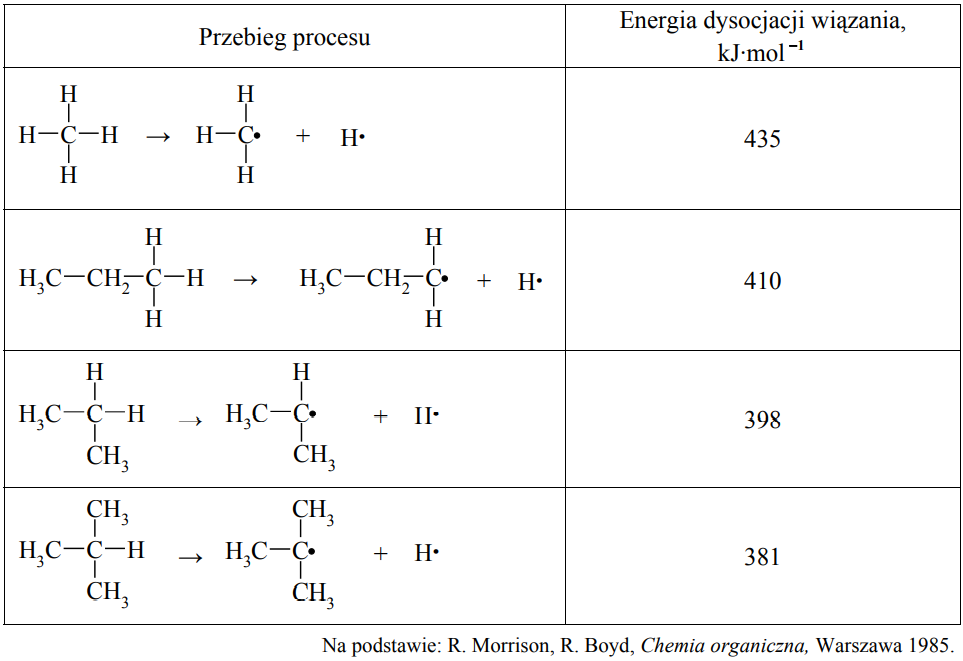
Można zauważyć, że łatwość odrywania atomu wodoru od cząsteczki alkanu zależy od rzędowości atomu węgla, z którym jest on połączony.
Korzystając z informacji, podkreśl przybliżoną wartość energii dysocjacji wiązania C–H w etanie. 435 kJ·mol–1 410 kJ·mol–1 398 kJ·mol–1 381 kJ·mol–1
Wybór najłatwiej tworzącego się rodnika. Zadanie 18b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Energia dysocjacji wiązania C–H w alkanach (wyrażona w kJ·mol–1) to energia, jaką trzeba dostarczyć, aby przekształcić 1 mol alkanu w 1 mol atomów wodoru i 1 mol odpowiedniego rodnika organicznego. Przykłady takich procesów oraz odpowiadające im energie dysocjacji zestawiono w poniższej tabeli.

Można zauważyć, że łatwość odrywania atomu wodoru od cząsteczki alkanu zależy od rzędowości atomu węgla, z którym jest on połączony.
Spośród rodników, których wzory podano w informacji, wybierz i napisz wzór tego, który tworzy się najłatwiej.
Zapis wzorów grupowych węglowodorów będących produktami reakcji addycji dwóch cząsteczek 2-metylopropenu. Zadanie 19a. Arkusz CKE chemia maj 2013 rozszerzony (2 punkty)
W temperaturze około 80 °C i w obecności kwasu siarkowego(VI) cząsteczki 2-metylopropenu ulegają dimeryzacji zachodzącej według schematu:
![]()
W mieszaninie poreakcyjnej stwierdza się obecność dwóch alkenów o podanym wzorze sumarycznym, różniących się położeniem wiązania podwójnego w cząsteczce. W wyniku całkowitego uwodornienia mieszaniny powstaje jeden związek 2,2,4-trimetylopentan.
Napisz wzory półstrukturalne (grupowe) obu izomerów, powstających w reakcji addycji dwóch cząsteczek 2-metylopropenu. Izomer I: Izomer II:
Wskazanie mechanizmu reakcji chemicznej. Zadanie 19b. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
W temperaturze około 80 °C i w obecności kwasu siarkowego(VI) cząsteczki 2-metylopropenu ulegają dimeryzacji zachodzącej według schematu:
![]()
W mieszaninie poreakcyjnej stwierdza się obecność dwóch alkenów o podanym wzorze sumarycznym, różniących się położeniem wiązania podwójnego w cząsteczce. W wyniku całkowitego uwodornienia mieszaniny powstaje jeden związek 2,2,4-trimetylopentan.
Określ, według jakiego mechanizmu, nukleofilowego czy elektrofilowego, przebiega reakcja uwodornienia każdego z opisanych izomerów, w wyniku której powstaje 2,2,4-trimetylopentan.