Zapis równania reakcji kwasu winowego z metanolem. Zadanie 22. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Poniżej przedstawiono wzory dwóch kwasów dikarboksylowych występujących w przyrodzie.

Napisz równanie reakcji kwasu winowego z alkoholem metylowym w obecności kwasu siarkowego(VI), w której powstaje produkt zawierający w cząsteczce sześć atomów węgla. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.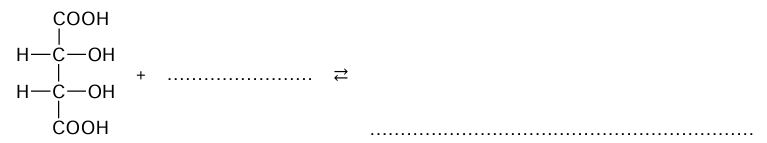
Ocena poprawności zdań dotyczących reakcji kwasu winowego. Zadanie 23. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Kwas winowy jest stałą, krystaliczną substancją, dobrze rozpuszczalną w wodzie. Wodorowinian potasu KHC4H4O6, zwany kamieniem winnym, jest solą trudno rozpuszczalną w wodzie. Roztwarza się w wodnym roztworze wodorotlenku potasu.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Po zmieszaniu jednakowych objętości wodnego roztworu wodorotlenku potasu i wodnego roztworu kwasu winowego o takich samych stężeniach molowych powstaje osad. 2. Po zmieszaniu jednakowych objętości wodnego roztworu winianu potasu i wodnego roztworu kwasu winowego o takich samych stężeniach molowych powstaje osad.
Zapis równania reakcji wodorowinianu potasu z roztworem KOH. Zadanie 24. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Kwas winowy jest stałą, krystaliczną substancją, dobrze rozpuszczalną w wodzie. Wodorowinian potasu KHC4H4O6, zwany kamieniem winnym, jest solą trudno rozpuszczalną w wodzie. Roztwarza się w wodnym roztworze wodorotlenku potasu.
Napisz w formie jonowej równanie reakcji, która zachodzi podczas roztwarzania wodorowinianu potasu w wodnym roztworze wodorotlenku potasu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Wskazanie nazwy monomeru oraz typu polireakcji. Zadanie 25. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Poniżej przedstawiono wzór pewnego polimeru:
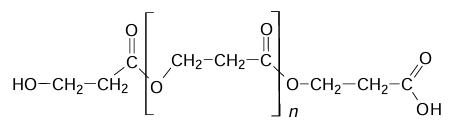
Napisz nazwę systematyczną monomeru o budowie łańcuchowej, z którego można otrzymać polimer o powyższym wzorze. Rozstrzygnij, czy ten polimer powstał w reakcji polikondensacji. Uzasadnij swoją odpowiedź. Nazwa systematyczna monomeru: Rozstrzygnięcie: Uzasadnienie:
Ustalenie wzoru empirycznego oraz grupowego związku chemicznego. Zadanie 26. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Próbkę związku X o masie 3,01 g poddano analizie spaleniowej i otrzymano 3,92 dm3 CO2 (w przeliczeniu na warunki normalne) oraz 3,15 g wody. O związku X wiadomo, że:
– może utworzyć dwie monochloropochodne,
– nie odbarwia wody bromowej i nie reaguje z odczynnikiem Tollensa,
– jego cząsteczki mają nierozgałęziony łańcuch węglowy.
Ustal wzór empiryczny, który jest jednocześnie wzorem rzeczywistym, związku X. Napisz jego wzór półstrukturalny (grupowy).
Ocena poprawności zdań dotyczących związku chemicznego. Zadanie 27.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Poniżej przedstawiono wzór cząsteczki pewnego związku:
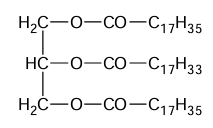
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Związek o przedstawionym wzorze można zaliczyć do grupy tłuszczów. 2. W wyniku hydrolizy zasadowej związku o przedstawionym wzorze powstaje, oprócz glicerolu, mieszanina kwasów tłuszczowych.
Rozstrzygnięcie chiralności cząsteczek związku chemicznego. Zadanie 27.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Poniżej przedstawiono wzór cząsteczki pewnego związku:

Rozstrzygnij, czy cząsteczki tego związku są chiralne. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Wskazanie stopnia utlenienia oraz typu hybrydyzacji orbitali walencyjnych atomów węgla. Zadanie 28.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Poniżej przedstawiono wzór pirydoksalu – jednego ze składników witaminy B6.
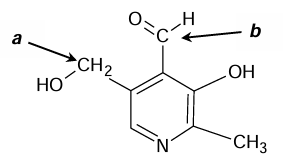
Atom azotu ma wolną parę elektronową, dlatego pirydoksal – podobnie jak inne aminy – reaguje z kwasami.
Uzupełnij tabelę. Wpisz formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą 𝒂 oraz atomu węgla oznaczonego literą 𝒃 we wzorze pirydoksalu.
uzupełnienie schematów reakcji z udziałem witaminy B6. Zadanie 28.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Poniżej przedstawiono wzór pirydoksalu – jednego ze składników witaminy B6.

Atom azotu ma wolną parę elektronową, dlatego pirydoksal – podobnie jak inne aminy – reaguje z kwasami.
Uzupełnij poniższe schematy. Wpisz wzory organicznych produktów przemian, tak aby powstały zapisane w formie jonowej skróconej równania reakcji pirydoksalu: – z wodorotlenkiem sodu (reakcja 1.) – z kwasem solnym (reakcja 2.). Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.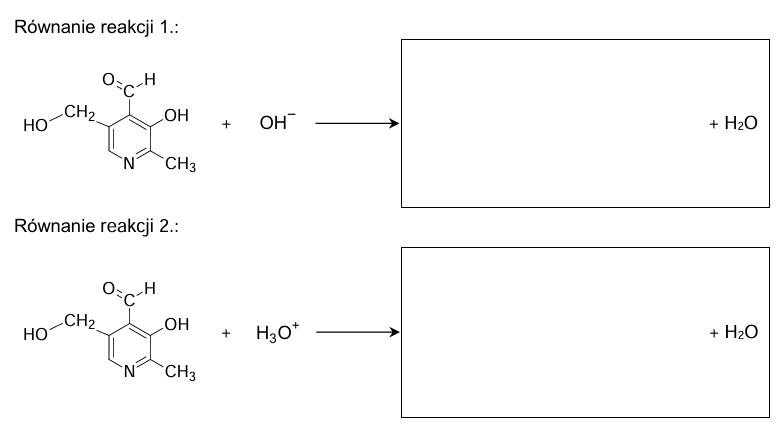
Wybór właściwych substancji użytych podczas doświadczenia chemicznego. Zadanie 29. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Nitrobenzen i anilina (benzenoamina) są bezbarwnymi cieczami, które na powietrzu i pod wpływem światła przyjmują żółte zabarwienie.
W pierwszym etapie jedną z opisanych cieczy wprowadzono do zlewki z wodą, wymieszano i pozostawiono na pewien czas. Zaobserwowano, że w naczyniu znajdowały się krople żółtej cieczy, a uniwersalny papierek wskaźnikowy zanurzony w badanym roztworze przyjął zielononiebieskie zabarwienie. W drugim etapie do mieszaniny dodano roztwór substancji X i otrzymano klarowny roztwór.
Rozstrzygnij, który związek (nitrobenzen albo anilina) został wprowadzony do wody w opisanym doświadczeniu. Uzasadnij swoją odpowiedź. Rozstrzygnięcie: Uzasadnienie: Spośród wymienionych niżej substancji wybierz tę, która mogła być użyta w drugim etapie doświadczenia, i zaznacz jej wzór. Wyjaśnij przyczynę zaobserwowanych zmian. W drugim etapie doświadczenia można było użyć: KOH, HCl, NaCl, NH3 Wyjaśnienie:
Obliczanie pH nasyconego roztworu aniliny. Zadanie 30. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
W temperaturze 25 °C w 100 g wody rozpuszcza się 3,5 g aniliny.
Oblicz pH wodnego roztworu aniliny nasyconego w temperaturze 25 oC. Przyjmij, że masa molowa tego związku jest równa 93 g∙mol–1, a gęstość otrzymanego roztworu jest równa gęstości wody.
Ocena poprawności zdań dotyczących lecytyny. Zadanie 31. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Lecytyny są naturalnymi związkami o dużym znaczeniu biologicznym. Znalazły one zastosowanie m.in. w przemyśle spożywczym jako emulgatory, czyli substancje stabilizujące emulsję. Ogólną strukturę lecytyny przedstawia wzór:
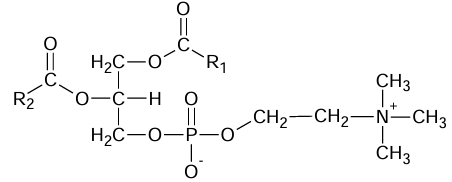
Symbolami –R1 i –R2 oznaczono grupy węglowodorowe. Najczęściej występujące łańcuchy węglowodorowe w cząsteczkach lecytyny wymieniono w poniższej tabeli.
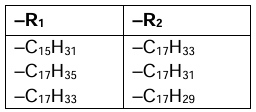
Cząsteczka lecytyny zawsze zawiera co najmniej jeden nienasycony łańcuch węglowodorowy.
Na podstawie: E. Siepka, Ł. Bobak, W. Gładkowski, Charakterystyka aktywności biologicznej fosfolipidów żółtka, „Żywność. Nauka. Technologia. Jakość”, 2015, nr 2(99).
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Istnieją cząsteczki lecytyny, które są achiralne. 2. Lecytyna jest substancją powierzchniowo czynną, ponieważ jej cząsteczka zawiera grupy polarne i łańcuchy niepolarne.
Wskazanie stosunku molowego reagentów. Zadanie 32.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Próbkę lecytyny ogrzewano z wodnym roztworem wodorotlenku sodu. Zaszła reakcja chemiczna, zgodnie ze schematem:
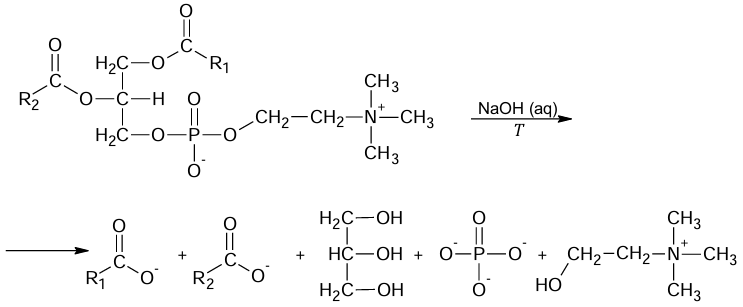
Uzupełnij zdanie. Określ stosunek liczby moli wodorotlenku sodu do liczby moli lecytyny w opisanej reakcji. Stosunek liczby moli wodorotlenku sodu do liczby moli lecytyny jest równy:
Zapis obserwacji oraz wzorów odpowiednich cząsteczek oraz jonów. Zadanie 32.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Próbkę lecytyny ogrzewano z wodnym roztworem wodorotlenku sodu. Zaszła reakcja chemiczna, zgodnie ze schematem:

W celu potwierdzenia obecności wybranych produktów reakcji mieszaninę poreakcyjną podzielono na trzy części i umieszczono w ponumerowanych probówkach. Do probówki 1. dodano wodę bromową, do 2. – zalkalizowaną świeżo strąconą zawiesinę wodorotlenku miedzi(II), natomiast do probówki 3. dodano kilka kropel wodnego roztworu chlorku wapnia.
Uzupełnij tabelę. Wpisz w odpowiednie miejsca: – obserwowane efekty reakcji, – wzory produktów (cząsteczki lub jednego wybranego jonu), których obecność była przyczyną obserwowanych efektów (w miejsce grup –R1 albo –R2 wpisz wzór odpowiedniej grupy węglowodorowej).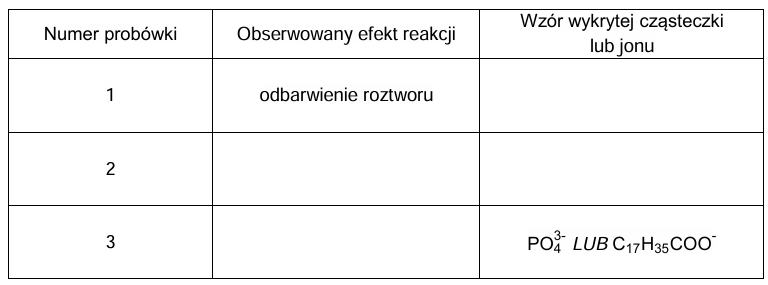
Wskazanie nazwy lub kodu aminokwasu C-końcowego w peptydzie. Zadanie 33. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Poniżej przedstawiono wzór pewnego tripeptydu
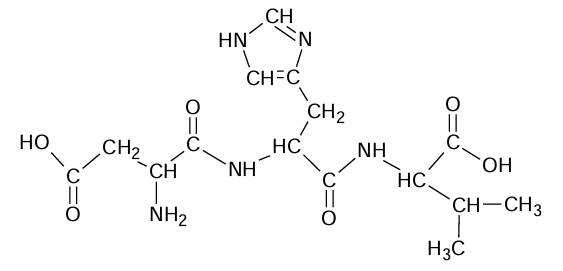
Napisz nazwę lub trzyliterowy kod aminokwasu C-końcowego, czyli tego którego reszta w cząsteczce tego tripeptydu zawiera wolną grupę karboksylową połączoną z atomem węgla 𝛂 aminokwasu.