Obliczenie procentu masy MgO w mieszaninie. Zadanie 11. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3–. W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Przeprowadzono następujące doświadczenie: próbkę magnezu spalono w powietrzu i otrzymano 0,15 g mieszaniny tlenku i azotku magnezu. W reakcji tej mieszaniny z wodą wydzielił się gaz o objętości równej 4,7 cm3 w przeliczeniu na warunki normalne.
Oblicz, jaki procent masy mieszaniny tlenku i azotku magnezu stanowi MgO. Przyjmij, że reakcja wydzielania gazu zaszła z wydajnością równą 100%.
Wybór właściwych wyrazów w zdaniach dotyczących przeprowadzonego eksperymentu. Zadanie 12. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A.M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wartość pH wody, w której rozpuszcza się CO2, (rośnie / maleje). Przy wzroście ciśnienia tlenku węgla(IV) w mieszaninie gazów nad roztworem, w układzie mającym temperaturę 𝑇, od wartości 0,0 kPa do wartości 1,0 kPa następuje ok. 100-krotny (wzrost / spadek) stężenia jonów Ca2+ w wodzie.
Zapis w formie jonowej równania reakcji chemicznej. Zadanie 13.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A.M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
Przez zawiesinę znajdującą się w pierwszej probówce przepuszczono CO2 i zaobserwowano zanik osadu.
Napisz w formie jonowej równanie reakcji zachodzącej w tej probówce.
Zapis w formie jonowej skróconej równania reakcji chemicznej na podstawie obserwacji. Zadanie 13.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A.M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
Do drugiej probówki dodano niewielką ilość świeżo przygotowanego wodnego roztworu KI i nie zaobserwowano żadnych zmian. Następnie przez zawiesinę znajdującą się w tej probówce przepuszczono CO2. W probówce powstał osad o żółtej barwie.
Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną obserwowanych zmian.
Obliczanie wydajności reakcji strąceniowej. Zadanie 14. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
W temperaturze 𝑇 do zlewki zawierającej 50,0 g wodnego roztworu jodku potasu o stężeniu równym 2,00 % dodano 100 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu równym 0,0300 mol∙dm−3. Przebiegła reakcja wytrącania PbI2. Otrzymany osad po odsączeniu i wysuszeniu ważył 1,24 g.
Oblicz wydajność reakcji otrzymywania jodku ołowiu(II) w doświadczeniu w temperaturze T.
Rozstrzygnięcie dotyczące dwuczęściowego doświadczenia. Zadanie 15. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Do zlewki zawierającej wodę destylowaną dodano stały wodorotlenek magnezu. Po pewnym czasie w zlewce ustalił się stan równowagi między osadem i roztworem, czyli powstał nasycony roztwór tej substancji. Osad oddzielono od roztworu, a otrzymany przesącz umieszczono w dwóch probówkach. Do jednej probówki wprowadzono stały wodorotlenek potasu, a do drugiej – rozcieńczony kwas solny, co zilustrowano na poniższym rysunku. Podczas doświadczenia utrzymywano stałą temperaturę 𝑇.
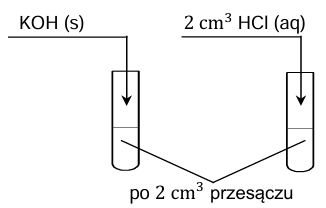
Rozstrzygnij, czy dodanie stałego wodorotlenku potasu do jednej próbki przesączu i kwasu solnego do drugiej próbki poskutkowało zmianą stężenia jonów Mg2+ w roztworze (w temperaturze T). Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Odpowiedzi uzasadnij. Dodanie stałego wodorotlenku potasu do próbki przesączu (poskutkowało zmniejszeniem / poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze. Uzasadnienie: Dodanie kwasu solnego do próbki przesączu (poskutkowało zmniejszeniem / poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze. Uzasadnienie:
Zapis równań połówkowych reakcji utleniania oraz redukcji. Zadanie 16. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Po wprowadzeniu tlenku chloru(IV) do wodnego roztworu wodorotlenku sodu zachodzi reakcja opisana schematem:
ClO2 + OH– ⟶ ClO2– + ClO3– + H2O
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania reakcji redukcji i utleniania zachodzących podczas opisanego procesu. Uwzględnij środowisko reakcji. Równanie reakcji redukcji: Równanie reakcji utleniania:
Zapis w formie jonowej skróconej równania reakcji chemicznej. Zadanie 17.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:
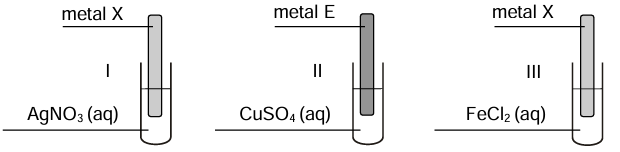
Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
Zastosuj symbol X i napisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce I.
Ocena poprawności zdań dotyczących doświadczenia z udziałem metali oraz roztworów soli. Zadanie 17.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:

Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Metal X jest silniejszym reduktorem niż srebro. 2. Jony żelaza(II) są silniejszym utleniaczem niż jony metalu X.
Zapis nazw metali użytych podczas doświadczenia. Zadanie 17.3. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:

Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
Poniżej podano nazwy czterech metali.
magnez miedź kadm srebro
Wybierz i napisz nazwę metalu X i nazwę metalu E, które mogły być użyte w doświadczeniu. Metal X: Metal E:
Wybór właściwych wyrazów dotyczących reakcji uwodornienia. Zadanie 18. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
W tabeli podano wartości standardowej entalpii uwodornienia: cykloheksenu, cykloheksa-1,3-dienu i benzenu:
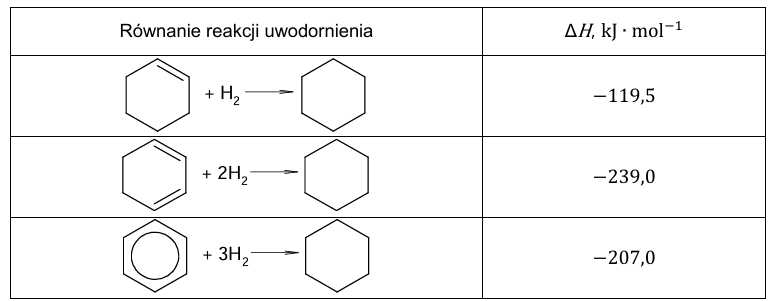
Na podstawie danych zamieszczonych w tabeli uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Gdyby wiązania 𝜋 w cząsteczce benzenu nie były zdelokalizowane, entalpia uwodornienia tego związku miałaby znacznie (niższą / wyższą) wartość niż −207,0 kJ∙mol−1. Delokalizacja wiązań 𝜋 skutkuje (zwiększeniem / zmniejszeniem) trwałości cząsteczki benzenu.
Zapis równania reakcji otrzymywania alkoholu ze styrenu. Zadanie 19. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Propan-1-ol oraz wyższe alkohole pierwszorzędowe można otrzymać w procesie hydroformylowania alkenów terminalnych. Reakcja przebiega w warunkach podwyższonego ciśnienia i temperatury, w obecności katalizatorów (Co lub Ru) według schematu:
![]()
Na podstawie: R. Franke, D. Selent, A. Börner, Applied Hydroformylation, „Chem. Rev.” 2012, nr 112 (11), s. 5675–5732,
oraz I. Ojima, C.Y. Tsai, M. Tzamarioudaki, D. Bonafoux, The Hydroformylation Reaction, „Org. React.” 2000, nr 56, s. 1.
Napisz równanie reakcji otrzymywania alkoholu ze styrenu (fenyloetenu) opisaną metodą. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Wpisanie nazw kwasów użytych podczas eksperymentu. Zadanie 20.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
W zlewkach I, II i III umieszczono – w przypadkowej kolejności – wodne roztwory kwasów:
mlekowego (2-hydroksypropanowego), migdałowego (2-fenylo-2-hydroksyetanowego) i galusowego (3,4,5-trihydroksybenzenokarboksylowego). Wzory kwasów przedstawiono
poniżej.
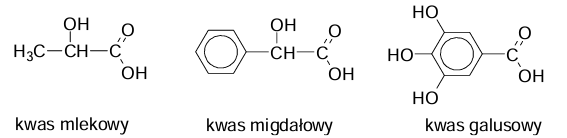
W celu zidentyfikowania substancji przeprowadzono dwie próby.
W pierwszej próbie do trzech probówek z wodnym roztworem chlorku żelaza(III) wprowadzono po kilka kropel roztworów badanych substancji ze zlewek I, II i III. Do każdej probówki z chlorkiem żelaza(III) dodano roztwór jednego kwasu.
W drugiej próbie w trzech probówkach umieszczono po jednej z identyfikowanych substancji, oznaczając je zgodnie z oznaczeniem zlewki z której zostały pobrane. Następnie do probówek wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) i probówki ogrzano.
Wyniki przeprowadzonych prób przedstawiono w poniższej tabeli.
Uzupełnij tabelę. Wpisz nazwy kwasów, które były obecne w zlewkach I, II i III.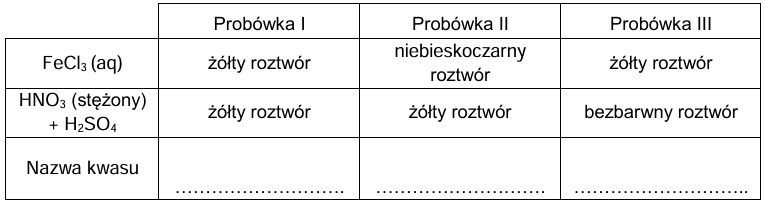
Wybór właściwego odczynnika oraz zapis obserwacji. Zadanie 21. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Poniżej przedstawiono wzory dwóch kwasów dikarboksylowych występujących w przyrodzie.

Przygotowano wodne roztwory soli sodowych kwasów: winowego i bursztynowego.
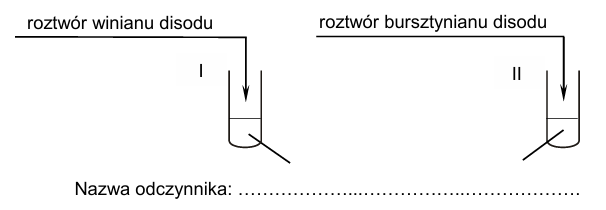
Uzupełnij schemat doświadczenia, które umożliwi rozróżnienie tych roztworów. Napisz nazwę odczynnika. Opisz obserwacje, które umożliwią identyfikację zawartości każdej probówki. Lista odczynników: Obserwacje: Probówka z winianem disodu: Probówka z bursztynianem disodu:
− rozcieńczony kwas solny z oranżem metylowym
− wodny roztwór wodorotlenku sodu z fenoloftaleiną
− zalkalizowana świeżo strącona zawiesina wodorotlenku miedzi(II)
− mieszanina stężonych kwasów: azotowego(V) i siarkowego(VI).