Zapis symbolu nuklidu. Zadanie 1.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
Uzupełnij poniższy schemat. Wpisz w odpowiednie pola symbol pierwiastka E, jego liczbę atomową oraz liczbę masową opisanego izotopu.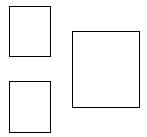
Zapis walencyjnej konfiguracji elektronowej atomu. Zadanie 1.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
Napisz fragment konfiguracji elektronowej atomu X w stanie podstawowym opisujący rozmieszczenie elektronów walencyjnych na orbitalach. Zastosuj graficzny (klatkowy) zapis konfiguracji elektronowej. W zapisie uwzględnij numer powłoki i symbole podpowłok.
Zapis wzoru sumarycznego tlenku oraz określenie charakteru chemicznego. Zadanie 1.3. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
Pierwiastek E przyjmuje w związkach chemicznych jeden stopień utlenienia, a pierwiastek X tworzy związki, w których występuje na różnych stopniach utlenienia.
Określ charakter chemiczny (kwasowy, zasadowy, amfoteryczny, obojętny) tlenku pierwiastka E. Napisz wzór sumaryczny tlenku pierwiastka X, w którym ten pierwiastek przyjmuje najwyższy stopień utlenienia. Charakter chemiczny tlenku pierwiastka E: Wzór sumaryczny tlenku pierwiastka X na najwyższym stopniu utlenienia:
Rysowanie wzoru elektronowego chlorku galu(III). Zadanie 2.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.
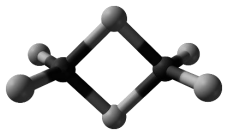
Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Narysuj wzór elektronowy monomeru chlorku galu(III). Zaznacz kreskami wiążące i wolne pary elektronowe.
Zapis typów hybrydyzacji orbitali walencyjnych atomu galu. Zadanie 2.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.

Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Uzupełnij tabelę. Napisz, jaki typ hybrydyzacji (sp, sp2 albo sp3) przypisuje się orbitalom walencyjnym atomu galu w monomerze oraz w dimerze chlorku galu(III).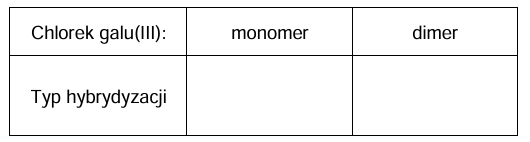
Wyjaśnienie przyczyny tworzenia się dimerów chlorku galu. Zadanie 2.3. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.

Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Wyjaśnij, dlaczego monomery chlorku galu(III) mają zdolność łączenia się w dimery. Uwzględnij sposób powstawania wiązań, dzięki którym z monomeru chlorku galu(III) powstaje dimer.
Wybór właściwych wyrazów w zdaniach dotyczących tytanu oraz jego chlorków. Zadanie 3.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Tytan jest lekkim metalem odpornym na korozję. W zależności od stopnia utlenienia tytanu chlorki tego pierwiastka odznaczają się różnymi właściwościami fizycznymi. Wartości temperatury topnienia i temperatury wrzenia dwóch związków tytanu z chlorem zestawiono
w poniższej tabeli.

Reakcja tlenku tytanu(IV) – o wzorze TiO2 – z tetrachlorometanem w temperaturze 500 °C prowadzi do powstania chlorku tytanu(IV) oraz tlenku węgla(IV) (reakcja 1.). Z kolei chlorek tytanu(II) – jako jedyny produkt reakcji – można otrzymać w wyniku przepuszczania par chlorku tytanu(IV) w temperaturze 1040 °C nad metalicznym tytanem (reakcja 2.).
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Uzupełnij poniższe zdania dotyczące tytanu i jego chlorków. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Sieć krystaliczna metalicznego tytanu składa się z (atomów / kationów) otoczonych chmurą zdelokalizowanych elektronów. W sieci krystalicznej chlorku tytanu(II) obecne są (atomy / jony). Wraz z obniżeniem stopnia utlenienia tytanu w chlorkach (maleje / rośnie) jonowy charakter wiązania.
Zapis równań reakcji chemicznych z rozstrzygnięciem czy są procesami redoks. Zadanie 3.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Tytan jest lekkim metalem odpornym na korozję. W zależności od stopnia utlenienia tytanu chlorki tego pierwiastka odznaczają się różnymi właściwościami fizycznymi. Wartości temperatury topnienia i temperatury wrzenia dwóch związków tytanu z chlorem zestawiono
w poniższej tabeli.

Reakcja tlenku tytanu(IV) – o wzorze TiO2 – z tetrachlorometanem w temperaturze 500 °C prowadzi do powstania chlorku tytanu(IV) oraz tlenku węgla(IV) (reakcja 1.). Z kolei chlorek tytanu(II) – jako jedyny produkt reakcji – można otrzymać w wyniku przepuszczania par chlorku tytanu(IV) w temperaturze 1040 °C nad metalicznym tytanem (reakcja 2.).
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Napisz w formie cząsteczkowej równania opisanych reakcji otrzymywania TiCl4 (reakcja 1.) i TiCl2 (reakcja 2.). Rozstrzygnij, czy dana przemiana jest reakcją utleniania-redukcji. Zaznacz TAK albo NIE. Równanie reakcji 1.: Rozstrzygnięcie: TAK NIE Równanie reakcji 2.: Rozstrzygnięcie: TAK NIE
Dokończenie zdania dotyczącego szybkości reakcji chemicznej. Zadanie 4. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Badano szybkość reakcji opisanej równaniem
(CH3) 3CCl (c) + H2O (c) → (CH3)3C(OH) (aq) + HCl (aq)
Dokończ zdanie. Wybierz odpowiedź A albo B i jej uzasadnienie 1., 2. albo 3. Pomiar pH roztworu, w którym zachodzi opisana reakcja,
Ocena poprawności zdań dotyczących reakcji syntezy chlorowodoru. Zadanie 5. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Poniżej przedstawiono równanie syntezy chlorowodoru.
H2 (g) + Cl2 (g) ⇄ 2HCl (g) Δ𝐻𝑜 < 0
Tę reakcję prowadzono w zamkniętym reaktorze i po pewnym czasie w układzie reakcyjnym ustaliła się równowaga.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Podwyższenie temperatury (w warunkach izobarycznych) skutkuje wzrostem wydajności tworzenia chlorowodoru. 2. Zmiana ciśnienia (w warunkach izotermicznych) nie wpływa na wydajność tworzenia chlorowodoru.
Określenie rodzaju efektu energetycznego reakcji chemicznej. Zadanie 6. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozstrzygnij, czy reakcja tlenku węgla(IV) z wodorem jest procesem endoenergetycznym. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Obliczenie stosunku molowego dwóch reagentów w stanie równowagi. Zadanie 7. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Do reaktora o stałej pojemności wprowadzono 10 moli tlenku węgla(IV) i 5 moli wodoru. Reaktor zamknięto i w temperaturze 800 K zainicjowano reakcję. Po pewnym czasie układ osiągnął stan równowagi.
Oblicz stosunek molowy tlenku węgla(IV) do wodoru w reaktorze po ustaleniu się stanu równowagi w temperaturze 800 K.
Zapis równania odpowiedniej reakcji chemicznej zgodnie z teorią Brønsteda. Zadanie 8. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Nawozy stosowane do zasilania gleby w azot mogą powodować jej zakwaszanie i nie powinny być stosowane do nawożenia gleb kwaśnych.
Spośród wymienionych poniżej związków: NaNO3, Ca(NO3)2, (NH4)2SO4 wybierz i zaznacz ten, który może spowodować dalsze zakwaszenie gleby kwaśnej. Napisz w formie jonowej równanie reakcji, której przebieg skutkuje zakwaszeniem gleby przez wybrany związek. Zastosuj definicję kwasu i zasady Brønsteda.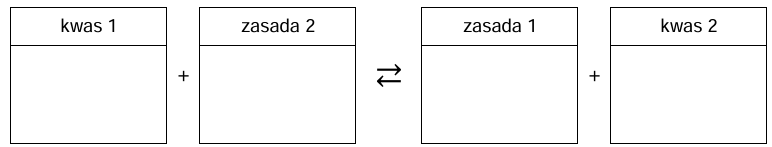
Wybór właściwego wodorotlenku oraz zapis jonowego równania reakcji chemicznej. Zadanie 9. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Zbadano właściwości dwóch wodorotlenków (I i II) wybranych spośród wymienionych poniżej.
Zn(OH)2, Mn(OH)2, Cu(OH)2, Cr(OH)3
W doświadczeniu użyto wodnego roztworu kwasu siarkowego(VI) oraz wodnego roztworu wodorotlenku sodu. Stwierdzono, że:
– wodorotlenek I roztworzył się zarówno w roztworze kwasu siarkowego(VI), jak i w roztworze wodorotlenku sodu. Powstały bezbarwne, klarowne roztwory
– wodorotlenek II roztworzył się zarówno w roztworze kwasu siarkowego(VI), jak i w roztworze wodorotlenku sodu. Powstały klarowne roztwory o barwie zielonej.
W reakcjach, w których powstają hydroksokompleksy, atom centralny w jonie kompleksowym ma liczbę koordynacyjną równą 4.
Wybierz i napisz wzór wodorotlenku I oraz napisz w formie jonowej równanie reakcji wodorotlenku II z wodorotlenkiem sodu. Wzór wodorotlenku I: Równanie reakcji wodorotlenku II z wodorotlenkiem sodu:
Wskazanie liczb kationów oraz anionów w jednym molu azotku magnezu. Zadanie 10. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3–. W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Uzupełnij tabelę. Uwzględnij stałą Avogadra i napisz, ile kationów magnezu i anionów azotkowych znajduje się w 1 molu azotku magnezu.