Obliczanie procentu masowego tlenku kobaltu(II) w wyjściowej mieszaninie tlenków. Zadanie 13. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
W celu określenia zawartości tlenku kobaltu(II) w mieszaninie zawierającej tylko CoO i Co3O4 próbkę tej mieszaniny o masie 100 g poddano prażeniu. Podczas tego procesu zaszły reakcje chemiczne:
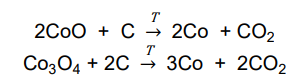
W wyniku zachodzących reakcji otrzymano 75,0 g metalicznego kobaltu.
Oblicz w procentach masowych zawartość tlenku kobaltu(II) w wyjściowej mieszaninie. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100 %.
Wskazanie procesu dominującego w układzie podczas każdego etapu miareczkowania roztworu. Zadanie 15. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
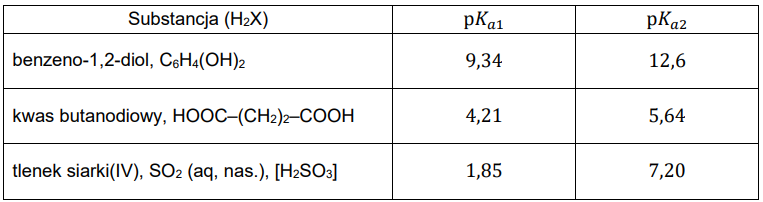
Poniżej przedstawiono informacje pozwalające porównać moc trzech substancji, które wykazują kwasowy charakter chemiczny w roztworach wodnych (𝑇 = 25 °C, 𝑝 = 1000 hPa):
Próbkę wodnego roztworu każdej z substancji (analitu) o objętości 10,0 cm3 i stężeniu molowym 0,020 mol ∙ dm–3, umieszczano w kolbie i miareczkowano roztworem titranta: NaOH (aq) o stężeniu molowym 0,020 mol ∙ dm–3. Krzywe miareczkowania oznaczone literami A, B i C przedstawiono na wykresie.
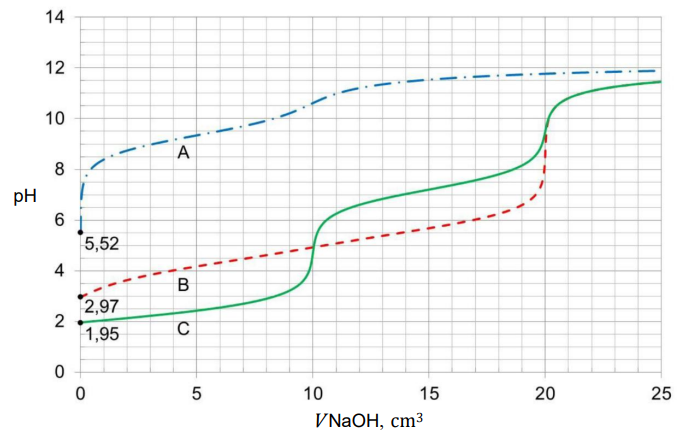
Punkt równoważnikowy (PR) to punkt na krzywej miareczkowania odpowiadający takiej ilości titranta, która jest równoważna stechiometrycznej ilości analitu. W pobliżu PR podczas miareczkowania zachodzą wyraźne zmiany wartości pH, zwane skokiem miareczkowania.
Schemat przedstawia zmiany barwy wskaźnika kwasowo-zasadowego – błękitu tymolowego
– w roztworach o różnej wartości pH (zakresy zmiany barwy: 1,2– 2,8 oraz 8,0– 9,6):

Na podstawie: W.M. Haynes, CRC Handbook of Chemistry and Physics, 97th edition, 2016.
W wodnych roztworach kwasów diprotonowych (H2X) oraz podczas miareczkowania ich roztworów za pomocą NaOH (aq) zachodzi wiele procesów, np.:
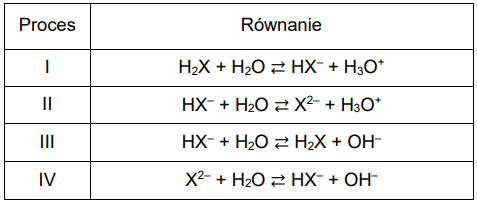
Na podstawie krzywej miareczkowania oznaczonej literą C wskaż, który z procesów I–IV decyduje o pH roztworu obecnego w kolbie, w różnych momentach miareczkowania. Uzupełnij poniższą tabelę. Wpisz numer procesu lub numery procesów. 
Ocena możliwości odróżnienia analitów po wprowadzeniu określonej ilości roztworu titranta. Zadanie 16. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Poniżej przedstawiono informacje pozwalające porównać moc trzech substancji, które wykazują kwasowy charakter chemiczny w roztworach wodnych (𝑇 = 25 °C, 𝑝 = 1000 hPa):

Próbkę wodnego roztworu każdej z substancji (analitu) o objętości 10,0 cm3 i stężeniu molowym 0,020 mol ∙ dm–3, umieszczano w kolbie i miareczkowano roztworem titranta: NaOH (aq) o stężeniu molowym 0,020 mol ∙ dm–3. Krzywe miareczkowania oznaczone literami A, B i C przedstawiono na wykresie.

Punkt równoważnikowy (PR) to punkt na krzywej miareczkowania odpowiadający takiej ilości titranta, która jest równoważna stechiometrycznej ilości analitu. W pobliżu PR podczas miareczkowania zachodzą wyraźne zmiany wartości pH, zwane skokiem miareczkowania.
Schemat przedstawia zmiany barwy wskaźnika kwasowo-zasadowego – błękitu tymolowego
– w roztworach o różnej wartości pH (zakresy zmiany barwy: 1,2– 2,8 oraz 8,0– 9,6):

Na podstawie: W.M. Haynes, CRC Handbook of Chemistry and Physics, 97th edition, 2016.
Przeanalizuj krzywe miareczkowania i rozstrzygnij, czy można odróżnić wszystkie badane roztwory przy użyciu błękitu tymolowego po wprowadzeniu 4 i 14 cm3 titranta. Zaznacz słowo TAK albo NIE przy każdym stwierdzeniu.
Obliczanie masy wykrystalizowanego hydratu. Zadanie 17. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
W 150 g wody o temperaturze 80 °C rozpuszczono 160 g bezwodnego tiosiarczanu sodu (Na2S2O3). Otrzymany roztwór ochłodzono do temperatury 20 °C.
Oblicz, ile gramów Na2S2O3 ∙ 5H2O wykrystalizuje po ochłodzeniu roztworu. W temperaturze 𝟐𝟎 °𝐂 rozpuszczalność hydratu wynosi 𝟏𝟕𝟔 𝐠 w 𝟏𝟎𝟎 𝐠 wody.
Obliczanie stężenia molowego kationów wapnia. Zadanie 18.1. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
W trzech zlewkach umieszczono:
• w zlewce A czystą wodę
• w zlewce B roztwór węglanu sodu
• w zlewce C kwas solny
o równych objętościach. Do każdej zlewki wprowadzono jednakową porcję stałego węglanu wapnia. Zawartość zlewek wymieszano i odstawiono. Stwierdzono, że w żadnej zlewce węglan wapnia nie uległ całkowitemu rozpuszczeniu. Temperatura wszystkich roztworów po zakończeniu doświadczenia wynosiła 25 °C.
Oblicz stężenie molowe jonów Ca2+ w roztworze otrzymanym w zlewce A po zakończeniu doświadczenia.
Wybór roztworów z uzasadnieniem, w których znajdowało się najwięcej oraz najmniej jonów wapnia. Zadanie 18.2. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
W trzech zlewkach umieszczono:
• w zlewce A czystą wodę
• w zlewce B roztwór węglanu sodu
• w zlewce C kwas solny
o równych objętościach. Do każdej zlewki wprowadzono jednakową porcję stałego węglanu wapnia. Zawartość zlewek wymieszano i odstawiono. Stwierdzono, że w żadnej zlewce węglan wapnia nie uległ całkowitemu rozpuszczeniu. Temperatura wszystkich roztworów po zakończeniu doświadczenia wynosiła 25 °C.
Rozstrzygnij, w której ze zlewek (A, B czy C) po zakończeniu doświadczenia znajdował się roztwór o największym stężeniu jonów Ca2+, a w której – roztwór o najmniejszym stężeniu jonów Ca2+. Zaznacz poprawną odpowiedź w każdym nawiasie i uzasadnij swoje stanowisko. W uzasadnieniu najmniejszego stężenia jonów Ca2+ odwołaj się do procesu równowagowego zachodzącego w roztworze. Najwięcej jonów Ca2+ znajdowało się w roztworze otrzymanym w zlewce (A / B / C). Uzasadnienie: Najmniej jonów Ca2+ znajdowało się w roztworze otrzymanym w zlewce (A / B / C). Uzasadnienie:
Obliczanie stężenia molowego roztworu wodorotlenku sodu przed zmieszaniem. Zadanie 19. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
Zmieszano 500 cm3 wodnego roztworu wodorotlenku sodu o nieznanym stężeniu 𝑐 (roztwór A) i 250 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,10 mol ∙ dm–3 (roztwór B). W temperaturze 25 °C pH otrzymanego roztworu C wynosiło 12,7.
Oblicz stężenie molowe 𝒄 roztworu A wodorotlenku sodu. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów. Wynik podaj z odpowiednią jednostką.
Zapis wzorów substancji które zidentyfikowano. Zadanie 20. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
W temperaturze 𝑇 sporządzono trzy bezbarwne wodne roztwory:
I – octanu sodu (CH3COONa)
II – kwasu octowego (CH3COOH)
III – wodorotlenku sodu (NaOH) o jednakowych stężeniach molowych równych 0,01 mol ∙ dm–3. Do identyfikacji tych roztworów wybrano dwa wskaźniki kwasowo-zasadowe: tymoloftaleinę i zieleń bromokrezolową. Wyniki doświadczenia przedstawiono na zdjęciach.
Uzupełnij tabelę. Wpisz wzory substancji, których wodne roztwory identyfikowano.
Wybór właściwych odczynników użytych podczas doświadczenia chemicznego. Zadanie 21.1. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Uczniowie przeprowadzili dwuetapowe doświadczenie, w którym w temperaturze pokojowej otrzymali z metalicznego glinu wodorotlenek glinu.
Wybierz i zaznacz na poniższym schemacie wzory odczynników, których użyto podczas doświadczenia przeprowadzonego przez uczniów.
Zapis równań reakcji chemicznych oraz opis obserwacji. Zadanie 21.2. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
Uczniowie przeprowadzili dwuetapowe doświadczenie, w którym w temperaturze pokojowej otrzymali z metalicznego glinu wodorotlenek glinu.
Zapisz w formie jonowej skróconej: Równania reakcji: Etap I: Etap II: Zaobserwowane zmiany:
• równanie reakcji zachodzącej w etapie I
• równanie reakcji zachodzącej w etapie II
opisanego doświadczenia, a następnie napisz, jakie zmiany zaobserwowano po dodaniu – w etapie II – nadmiaru wybranego odczynnika.
Zapis równania procesu redukcji w środowisku zasadowym. Zadanie 22.1. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Metaliczny cynk roztwarza się w alkalicznych roztworach zawierających aniony azotanowe(V) zgodnie ze schematem:
Zn + NO3– + OH– + H2O → Zn(OH)42 – + NH3
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie procesu redukcji zachodzącego podczas tej reakcji. Uwzględnij środowisko reakcji.
Dobór współczynników stechiometrycznych w schemacie reakcji redoks. Zadanie 22.2. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Metaliczny cynk roztwarza się w alkalicznych roztworach zawierających aniony azotanowe(V) zgodnie ze schematem:
Zn + NO3– + OH– + H2O → Zn(OH)42 – + NH3
Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.![]()
Zapis schematu ogniwa oraz równania sumarycznego reakcji chemicznej. Zadanie 23. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
Zbudowano ogniwo przedstawione na poniższym rysunku.
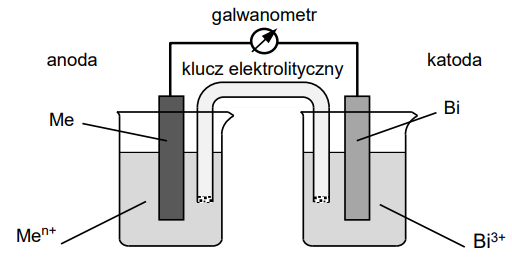
Siła elektromotoryczna tego ogniwa w warunkach standardowych była równa 0,565 V.
Napisz w formie jonowej skróconej sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie. Napisz schemat tego ogniwa. Równanie reakcji: Schemat ogniwa:
Ustalanie wzoru alkanu poddanego chlorowaniu pod wpływem światła. Zadanie 24. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
W reakcjach substytucji na świetle względna reaktywność atomów wodoru połączonych z atomami węgla o różnej rzędowości wskazuje, że najłatwiej ulega podstawieniu atom wodoru związany z atomem węgla o najwyższej rzędowości. Ilości poszczególnych produktów zależą od liczby atomów wodoru o określonej rzędowości oraz od ich reaktywności i są zwykle podawane w przeliczeniu na jeden atom wodoru jako tzw. współczynnik reaktywności. Względna ilość produktu reakcji substytucji jest iloczynem liczby atomów wodoru o określonej rzędowości i ich współczynnika reaktywności.
Dla reakcji monochlorowania w temperaturze pokojowej współczynniki reaktywności atomów wodoru wynoszą odpowiednio:
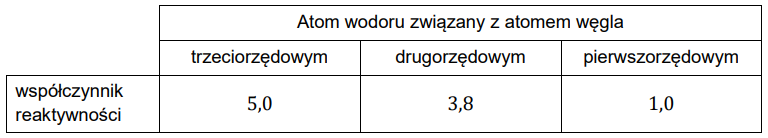
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 1996.
W wyniku reakcji monochlorowania na świetle jednego z alkanów o wzorze sumarycznym C4H10 otrzymano dwie izomeryczne monochloropochodne: 64 % izomeru A i 36 % izomeru B.
Na podstawie obliczeń ustal, który alkan poddano reakcji monochlorowania na świetle, a następnie napisz jego nazwę systematyczną.