Ustalanie symboli pierwiastków chemicznych oraz ich położenia w układzie okresowym. Zadanie 1. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
Dwa pierwiastki oznaczone literami X i E należą do tego samego okresu. Wiadomo, że w stanie podstawowym:
• atom pierwiastka X ma w zewnętrznej powłoce cztery elektrony sparowane i dwa niesparowane
• stan energetyczny niesparowanych elektronów atomu pierwiastka X opisują główna liczba kwantowa 𝑛 = 4 i poboczna liczba kwantowa 𝑙 = 1
• w atomie pierwiastka E liczba elektronów, które mogą brać udział w tworzeniu wiązań, jest taka sama jak w atomie pierwiastka X, jednak są one rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Wpisz do tabeli symbole chemiczne pierwiastków X i E, numer grupy i symbol bloku konfiguracyjnego, do których należy każdy z pierwiastków.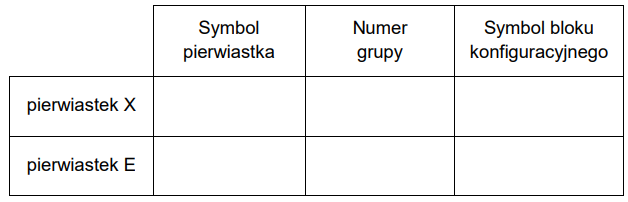
Przypisywanie najwyższego oraz najniższego stopnia utlenienia pierwiastkowi chemicznemu. Zadanie 2.1. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Dwa pierwiastki oznaczone literami X i E należą do tego samego okresu. Wiadomo, że w stanie podstawowym:
• atom pierwiastka X ma w zewnętrznej powłoce cztery elektrony sparowane i dwa niesparowane
• stan energetyczny niesparowanych elektronów atomu pierwiastka X opisują główna liczba kwantowa 𝑛 = 4 i poboczna liczba kwantowa 𝑙 = 1
• w atomie pierwiastka E liczba elektronów, które mogą brać udział w tworzeniu wiązań, jest taka sama jak w atomie pierwiastka X, jednak są one rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Pierwiastki X i E mogą przyjmować w związkach chemicznych różne stopnie utlenienia.
Napisz najwyższy i najniższy stopień utlenienia, jaki może przyjmować pierwiastek X w związkach chemicznych. Najwyższy stopień utlenienia: Najniższy stopień utlenienia:
Zapis wzorów sumarycznych tlenków spełniających określone warunki. Zadanie 2.2. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Dwa pierwiastki oznaczone literami X i E należą do tego samego okresu. Wiadomo, że w stanie podstawowym:
• atom pierwiastka X ma w zewnętrznej powłoce cztery elektrony sparowane i dwa niesparowane
• stan energetyczny niesparowanych elektronów atomu pierwiastka X opisują główna liczba kwantowa 𝑛 = 4 i poboczna liczba kwantowa 𝑙 = 1
• w atomie pierwiastka E liczba elektronów, które mogą brać udział w tworzeniu wiązań, jest taka sama jak w atomie pierwiastka X, jednak są one rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Przeprowadzono doświadczenie, którego wynik przedstawiono w tabeli. Znakiem + oznaczono te układy, w których zaobserwowano objawy reakcji.
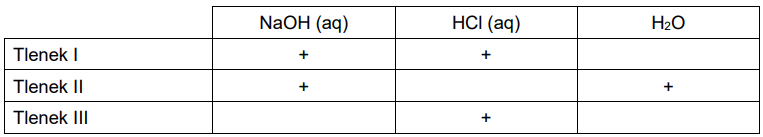
Napisz wzory trzech różnych tlenków pierwiastka E, spełniających podane warunki. Tlenek I: Tlenek II: Tlenek III:
Uzupełnienie schematu równania reakcji jądrowej. Zadanie 3. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Przebieg reakcji jądrowych można przedstawić w postaci zapisu skróconego. Na pierwszym miejscu podaje się symbol jądra bombardowanego, następnie w nawiasie – kolejno – symbole cząstki bombardującej i lekkiej cząstki emitowanej, a na końcu – symbol jądra produktu.
Pewien izotop kobaltu można otrzymać w przemianach jądrowych, których sumaryczny przebieg przedstawiono na poniższym schemacie. Symbol e oznacza elektron.
![]()
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz L. Jones, P. Atkins, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2016.
Napisz równanie przemiany jądrowej, która przebiega według powyższego schematu. Uzupełnij wszystkie pola odpowiednimi symbolami i wartościami liczbowymi.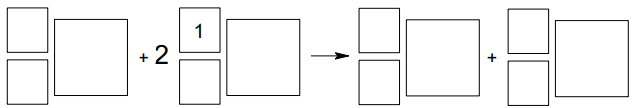
Wybór poprawnych określeń dotyczących wody. Zadanie 4. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
1) Tlen i siarka tworzą wodorki typu H2E. Energia oddziaływań pomiędzy cząsteczkami wody jest (większa / mniejsza) niż energia oddziaływań pomiędzy cząsteczkami siarkowodoru. 2) Woda w postaci lodu tworzy kryształ (molekularny / kowalencyjny).
Wybór ucznia wraz z uzasadnieniem, który sformułował właściwy wniosek dotyczący szybkości reakcji chemicznej. Zadanie 5. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
W roztworze alkoholowo-wodnym zawierającym bromometan oraz wodorotlenek sodu przebiega reakcja opisana równaniem:
CH3Br + OH− → CH3OH + Br−
Zależność szybkości tej reakcji od stężeń reagentów przedstawia równanie kinetyczne:
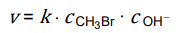
W temperaturze 55 °C wartość k jest równa 2,14 · 10–2 dm3 · mol–1 · s–1.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 1996.
Opisaną reakcję otrzymywania metanolu prowadzono w jednakowej temperaturze w dwóch roztworach (I i II) o równej początkowej liczbie moli jonów OH– i bromometanu. Wskutek użycia większej ilości rozpuszczalnika objętość roztworu II była dwukrotnie większa.
Trzej uczniowie – oznaczeni jako A, B i C – sformułowali wnioski dotyczące wpływu różnicy objętości roztworów na początkową szybkość reakcji. Wnioski poszczególnych uczniów zapisano w tabeli.

Rozstrzygnij, który uczeń (A, B czy C) sformułował poprawny wniosek. Odpowiedź uzasadnij. Poprawny wniosek sformułował uczeń: Uzasadnienie:
Obliczanie początkowego stężenia bromometanu. Zadanie 6. Arkusz CKE chemia czerwiec 2023 rozszerzony (2 punkty)
W roztworze alkoholowo-wodnym zawierającym bromometan oraz wodorotlenek sodu przebiega reakcja opisana równaniem:
CH3Br + OH− → CH3OH + Br−
Zależność szybkości tej reakcji od stężeń reagentów przedstawia równanie kinetyczne:
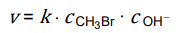
W temperaturze 55 °C wartość k jest równa 2,14·10–2 dm3 · mol–1 · s–1.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 1996.
Reakcję CH3Br z NaOH prowadzono w temperaturze 55 °C. Po pewnym czasie stężenie jonów OH− – wskutek przebiegu reakcji chemicznej – zmalało z 0,060 mol · dm–3 do wartości 0,050 mol · dm–3, a szybkość reakcji wynosiła 1,07·10–5 · mol dm–3 · s–1.
Oblicz początkowe stężenie molowe bromometanu.
Zapis równania reakcji zgodnie z teorią Brønsteda. Zadanie 7. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie procesu decydującego o odczynie roztworu fenolanu sodu. Zastosuj definicję kwasu i zasady Brønsteda. 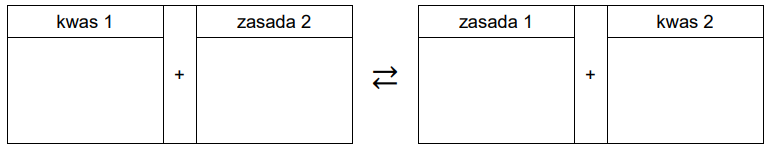
Uporządkowanie roztworów ze wzrostem pH. Zadanie 8. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Uporządkuj wymienione roztwory według wzrastającego pH. Uzupełnij poniższy schemat. Wpisz w wolne pola wzory substancji znajdujących się w roztworach.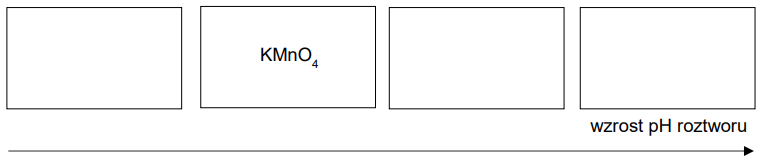
Przypisanie odpowiedniego odczynnika do właściwej probówki. Zadanie 9.1. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Roztwory z probówek 1.–4. posłużyły do przeprowadzenia doświadczenia. Do jednej z probówek wprowadzono tlenek węgla(IV), a do pozostałych dodano pojedynczo odczynniki: NaOH (aq), Na2SO3 (aq) oraz HCl (aq). Każdego z roztworów użyto jeden raz. Po wymieszaniu zawartości probówek w każdej z nich zaobserwowano zmętnienie lub wytrącenie osadu.
Ustal, do której probówki został wprowadzony tlenek węgla(IV), a do których – wodne roztwory: NaOH oraz HCl. Uzupełnij poniższe schematy.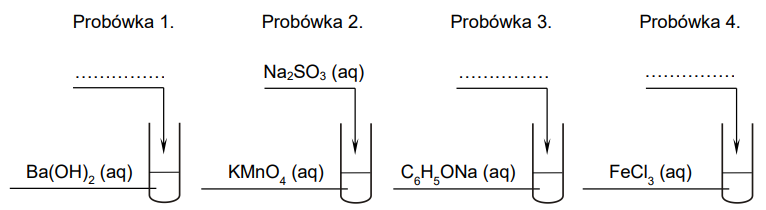
Zapis wzorów substancji chemicznych, których powstaniu towarzyszyły określone objawy. Zadanie 9.2. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Roztwory z probówek 1.–4. posłużyły do przeprowadzenia doświadczenia. Do jednej z probówek wprowadzono tlenek węgla(IV), a do pozostałych dodano pojedynczo odczynniki: NaOH (aq), Na2SO3 (aq) oraz HCl (aq). Każdego z roztworów użyto jeden raz. Po wymieszaniu zawartości probówek w każdej z nich zaobserwowano zmętnienie lub wytrącenie osadu.
Wpisz do tabeli wzory substancji, których powstanie w probówkach 1., 3. oraz 4. odpowiadało za opisany objaw reakcji.
Zapis równania reakcji w formie jonowej skróconej. Zadanie 9.3. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Roztwory z probówek 1.–4. posłużyły do przeprowadzenia doświadczenia. Do jednej z probówek wprowadzono tlenek węgla(IV), a do pozostałych dodano pojedynczo odczynniki: NaOH (aq), Na2SO3 (aq) oraz HCl (aq). Każdego z roztworów użyto jeden raz. Po wymieszaniu zawartości probówek w każdej z nich zaobserwowano zmętnienie lub wytrącenie osadu.
W probówce 2., po zmieszaniu reagentów, zachodzi proces utleniania-redukcji. Utleniacz i reduktor reagują ze sobą w stosunku molowym 2 : 3, a trzecim substratem reakcji jest woda.
Napisz w formie jonowej skróconej równanie tej reakcji.
Zapis równania reakcji otrzymywania tetraoksokrzemianu(IV) sodu ze wskazaniem stosunku masowego substratów. Zadanie 10. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz w formie cząsteczkowej równanie reakcji otrzymywania tetraoksokrzemianu(IV) sodu opisaną metodą. Oblicz stosunek masowy substratów. Równanie reakcji: Stosunek masowy:![]()
Zapis wzoru sumarycznego odpowiedniego wodoroanionu. Zadanie 11. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz wzór sumaryczny tego wodoroanionu kwasu tetraoksokrzemowego(IV), który zbudowany jest z siedmiu atomów.
Rysowanie wzoru elektronowego kreskowego kwasu tetraoksokrzemowego(IV) oraz wskazanie typu hybrydyzacji orbitali walencyjnych atomu krzemu. Zadanie 12. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Narysuj elektronowy wzór kreskowy kwasu tetraoksokrzemowego(IV). Określ typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu krzemu w cząsteczce tego kwasu. Elektronowy wzór kreskowy: Typ hybrydyzacji: