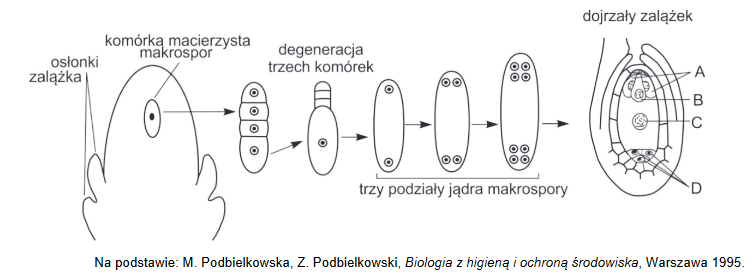
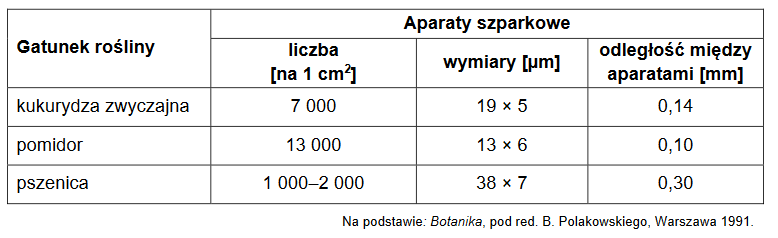
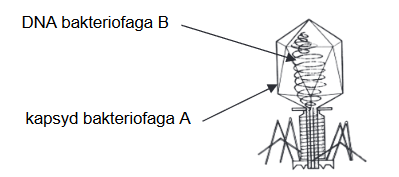
Organella komórki eukariotycznej – jądra komórkowe
Jądro komórkowe zawiera materiał genetyczny w postaci DNA. W jądrze komórkowym zachodzą intensywne procesy anaboliczne.
1. Zaznacz strukturę komórkową, w której skład wchodzą substancje wytwarzane wewnątrz jądra komórkowego.
A. gładka siateczka śródplazmatyczna
B. rybosom
C. aparat Golgiego
D. lizosom
2. Oceń, czy poniższe stwierdzenia dotyczące komórek eukariotycznych są prawdziwe. Zaznacz P, jeśli stwierdzenie jest prawdziwe, albo F – jeśli jest fałszywe.

Określanie symboli dwóch pierwiastków chemicznych oraz liczby ich elektronów niesparowanych. Zadanie 1. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Dwa pierwiastki, oznaczone numerami 1. i 2., należą do czwartego okresu układu okresowego. Liczba atomowa pierwiastka 1. jest mniejsza od liczby atomowej pierwiastka 2. Atomy (w stanie podstawowym) tych pierwiastków mają 4 elektrony, które mogą uczestniczyć w tworzeniu wiązań chemicznych.
Uzupełnij tabelę. Napisz nazwy pierwiastków 1. i 2. oraz określ, czy w atomach (w stanie podstawowym) tych pierwiastków występują niesparowane elektrony – podaj liczbę elektronów niesparowanych i napisz symbol podpowłoki, do której one należą, albo zaznacz, że nie ma takich elektronów.
Graficzny zapis konfiguracji elektronowej kationu bromoniowego. Zadanie 2. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Uzupełnij poniższy schemat tak, aby przedstawiał on graficzny zapis konfiguracji elektronowej kationu bromoniowego Br+ (stan podstawowy). W tym zapisie uwzględnij numery powłok i symbole podpowłok.
Wybór związku chemicznego zawierającego jony chlorkowe. Zadanie 3. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Spośród wymienionych poniżej substancji wybierz te, w skład których wchodzą jony Cl–. Podkreśl wzory wybranych związków. HCl (g) KCl (s) CH3Cl (g) CH3NH3Cl (s) NaClO (s) CaCl2 · 6H2O (s)
Wybór procesów, w których biorą udział rodniki chloru. Zadanie 4.1. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Poniżej przedstawiono schematy czterech przemian chemicznych A, B, C i D, w których jednym z substratów jest chlor.

Spośród przemian oznaczonych literami A, B, C i D wybierz te, w przebiegu których udział biorą rodniki chloru. Napisz litery, którymi oznaczono te przemiany.
Określenie efektu energetycznego reakcji chemicznej. Zadanie 5. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
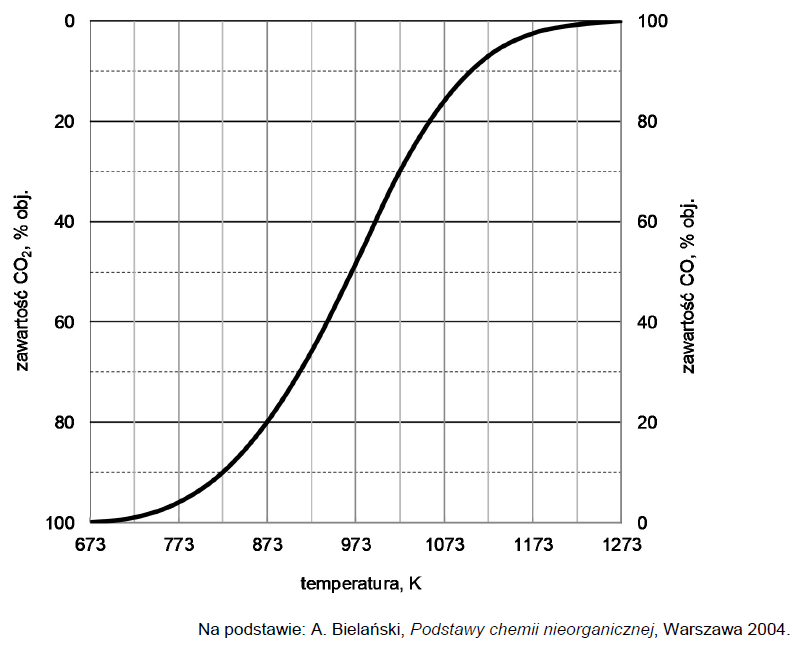
Rozstrzygnij, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem egzoenergetycznym. Uzasadnij swoją odpowiedź. Rozstrzygnięcie: Uzasadnienie:
Obliczanie wartości stałej stężeniowej reakcji chemicznej. Zadanie 6. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.

W mieszaninie gazów doskonałych sumaryczne stężenie molowe wyraża się wzorem:
![]()
gdzie:
𝑝 – ciśnienie w hPa
𝑇 – temperatura w K
𝑅 – stała gazowa równa 83,1 hPa∙dm3∙K–1∙mol–1.
Ponadto

Oblicz wartość stężeniowej stałej równowagi opisanej przemiany w temperaturze 873 K i pod ciśnieniem 1013 hPa. Wyrażenie na stężeniową stałą równowagi tej reakcji przyjmuje postać: Załóż, że CO i CO2 są gazami doskonałymi.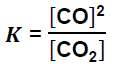
Zapis równań reakcji chemicznych z udziałem sodu, litu, tlenu i azotu. Zadanie 8. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa. Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli, a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu, związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia. Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
Napisz w formie cząsteczkowej równania opisanych w informacji przemian. Spalanie sodu w tlenie: Reakcja litu z azotem: