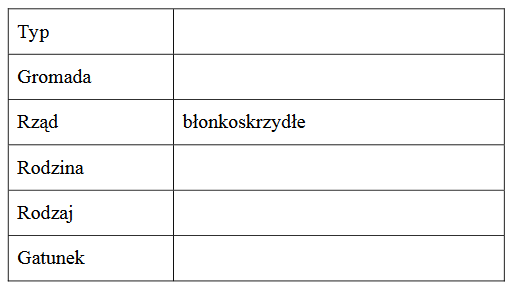
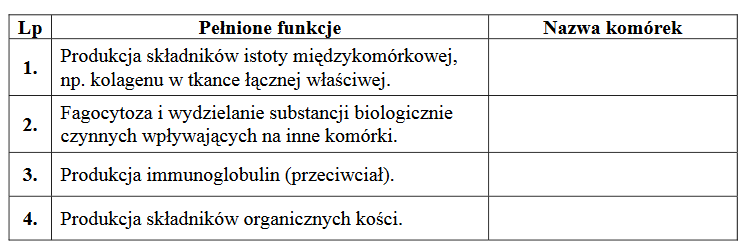
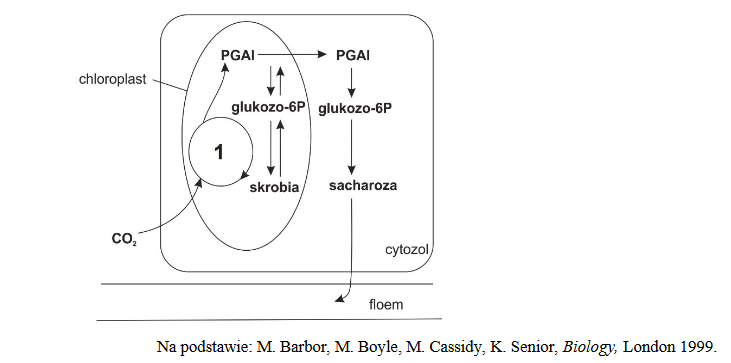
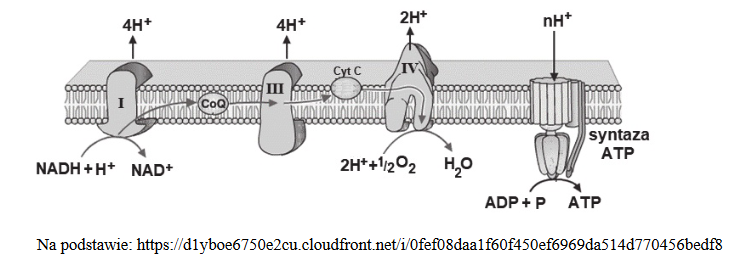
cząsteczki produkowane w jądrze komórkowym i poza nim
Spośród wymienionych cząsteczek i makrocząsteczek wybierz i podkreśl wyłącznie te, które powstają na terenie jądra komórkowego i są z niego eksportowane do cytoplazmy.
DNA
histony
mRNA
podjednostki rybosomów
tRNA
organella komórkowe - rozmiar rybosomów
Oceń, czy stwierdzenie „Wszystkie rybosomy w komórkach zwierzęcych są jednakowej wielkości” jest prawdziwe. Odpowiedź uzasadnij.
Określenie wzoru sumarycznego, modelu hybrydyzacji i liczby wiązań σ oraz π. Zadanie 1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Dwa pierwiastki oznaczono umownie literami X i Z. Dwuujemny jon pierwiastka Z ma konfigurację elektronową 1s22s22p63s23p6 w stanie podstawowym. Pierwiastki X i Z tworzą związek XZ2, w którym stosunek masowy pierwiastka X do pierwiastka Z jest równy 3 : 16. Cząsteczka tego związku ma budowę liniową.
Napisz wzór sumaryczny związku opisanego w informacji, zastępując umowne oznaczenia X i Z symbolami pierwiastków. Podaj typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu pierwiastka X tworzącego związek XZ2 oraz napisz liczbę wiązań typu σ i liczbę wiązań typu π występujących w cząsteczce opisanego związku chemicznego. Wzór sumaryczny: Typ hybrydyzacji: Liczba wiązań typu σ: Liczba wiązań typu π:
Ocena poprawności zdań na podstawie diagramu fazowego tlenku węgla(IV). Zadanie 2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Poniższy diagram fazowy tlenku węgla(IV) przedstawia wartości temperatury i ciśnienia, w których CO2 występuje w różnych fazach: w stanie stałym, ciekłym lub gazowym. Linie ciągłe określają warunki temperatury i ciśnienia, w których istnieje trwała równowaga między dwiema fazami. W punkcie oznaczonym symbolem P3 (T = 216 K i p = 5100 hPa) CO2 występuje w trzech fazach znajdujących się w stanie równowagi.
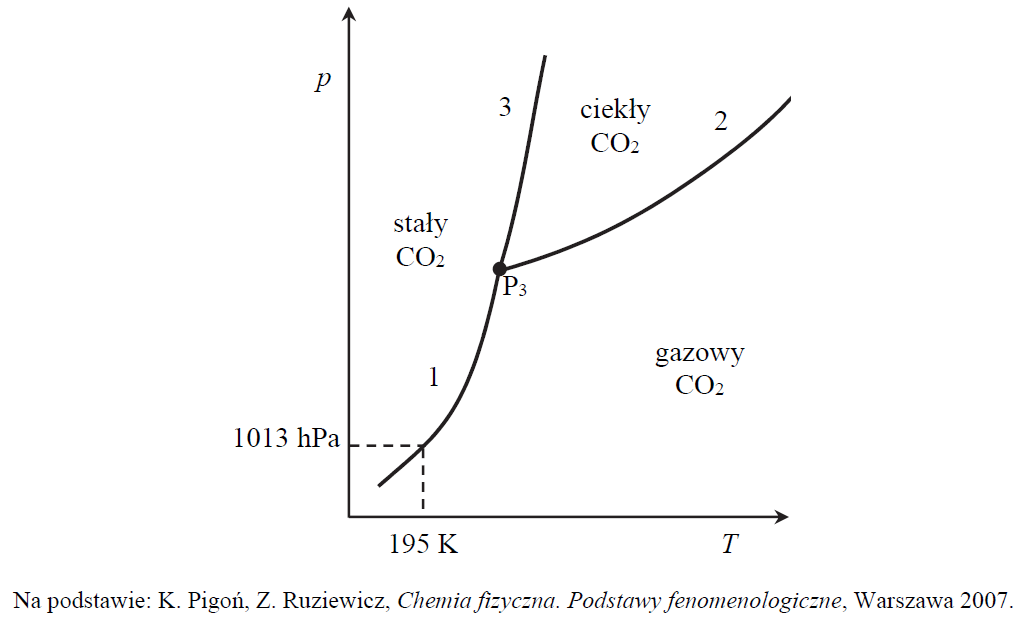
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Pod ciśnieniem wyższym od 5100 hPa tlenek węgla(IV) nie występuje w ciekłym stanie skupienia. 2. W temperaturze 195 K i pod ciśnieniem 1013 hPa stały tlenek węgla(IV) może ulegać sublimacji. 3. Zmianę wartości temperatury topnienia tlenku węgla(IV) w zależności od ciśnienia ilustruje krzywa oznaczona numerem 2.
Wybór poprawnych określeń dotyczących różnych rodzajów kryształów. Zadanie 3. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Uzupełnij poniższe zdania dotyczące czterech różnych rodzajów kryształów. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
W kryształach metalicznych sieć krystaliczna zbudowana jest z (atomów / cząsteczek / kationów i anionów / kationów metali) otoczonych chmurą zdelokalizowanych elektronów. Elementami, z których zbudowana jest sieć krystaliczna tlenku wapnia, są (atomy / cząsteczki / kationy i aniony). W kryształach molekularnych dominują oddziaływania międzycząsteczkowe, a w kryształach kowalencyjnych atomy tworzące sieć krystaliczną połączone są wiązaniami kowalencyjnymi. Przykładem kryształu molekularnego jest kryształ (chlorku sodu / sacharozy / wapnia), a przykładem kryształu kowalencyjnego – kryształ (diamentu / jodu / węglanu wapnia).
Zapis równania reakcji jonu tlenkowego z cząsteczką wody. Zadanie 4. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.