Określanie wzoru sumarycznego węglowodoru na podstawie danych ilościowych spalania składników mieszaniny. Zadanie 23. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Do całkowitego spalenia 2,80 dm3 (odmierzonych w warunkach normalnych) mieszaniny zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu potrzeba 13,16 dm3 tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
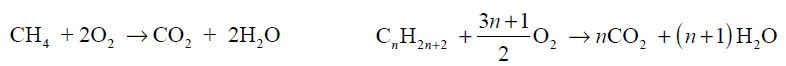
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu stanowiącego 60% objętości opisanej mieszaniny.
Wybór poprawnych wyrazów dotyczących reakcji addycji przebiegającej według różnych mechanizmów. Zadanie 24. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Na przebieg reakcji propenu z bromowodorem ma wpływ obecność nadtlenków w mieszaninie reakcyjnej, co zilustrowano na poniższym schemacie.
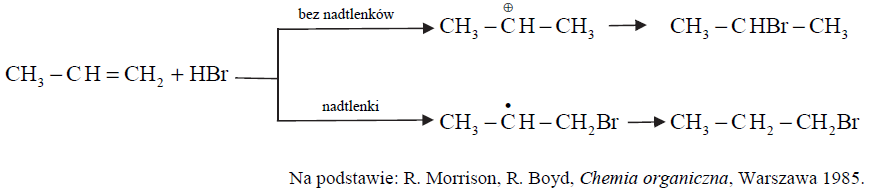
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Gdy w środowisku reakcji nie ma nadtlenków, bromowodór przyłącza się do propenu (niezgodnie / zgodnie) z regułą Markownikowa. Ta addycja przebiega poprzez tworzenie drobin z ładunkiem dodatnim zlokalizowanym na atomie węgla. Jest to addycja (rodnikowa / nukleofilowa / elektrofilowa) do podwójnego wiązania węgiel – węgiel. Gdy w środowisku reakcji są obecne nadtlenki, addycja jest (niezgodna / zgodna) z regułą Markownikowa. W tej reakcji przejściowo tworzy się (karbokation pierwszorzędowy / karbokation drugorzędowy / rodnik pierwszorzędowy / rodnik drugorzędowy).
Zapis równania reakcji uwodornienia węglowodoru, którego wzór trzeba odszyfrować. Zadanie 25. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
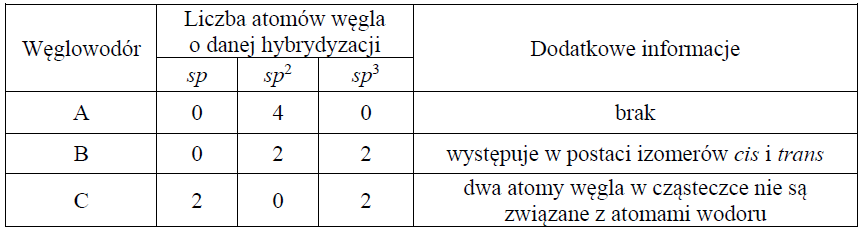
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.
Przeprowadzono reakcję węglowodoru A z wodorem, w której stosunek molowy węglowodoru do wodoru był równy nwęglowodoru A : nH2 = 1: 2.
Napisz równanie reakcji węglowodoru A z wodorem. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Rysowanie wzoru izomeru cis węglowodoru, którego wzór trzeba odszyfrować. Zadanie 26. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.

Narysuj wzór półstrukturalny (grupowy) izomeru cis węglowodoru B.
Zapis wzoru półstrukturalnego trwałego produktu reakcji addycji wody do węglowodoru. Zadanie 27. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.

Przeprowadzono reakcję węglowodoru C z wodą w stosunku molowym nwęglowodoru C : nwody = 1:1
Napisz wzór półstrukturalny (grupowy) trwałego (dominującego) produktu reakcji, której substratami są węglowodór C i woda.
Zapis równania reakcji chloroetanu z litem oraz równania reakcji metylolitu z wodą. Zadanie 28.1. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Napisz: • w formie cząsteczkowej równanie reakcji chloroetanu z litem. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych). • w formie cząsteczkowej równanie reakcji metylolitu (CH3Li) z wodą.
Zapis równania reakcji tworzenia 2-metylopropanu z wykorzystaniem odczynnika Gilmana. Zadanie 28.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Przeprowadzono reakcję, podczas której na drugorzędową chloropochodną alkanu podziałano odczynnikiem Gilmana. Wśród produktów reakcji obecny był 2-metylopropan.
Napisz w formie cząsteczkowej równanie opisanej reakcji. Chloropochodną alkanu oraz 2-metylopropan przedstaw za pomocą wzorów półstrukturalnych (grupowych).
Określenie rodzaju wiązania chemicznego między węglem oraz litem w butylolicie. Zadanie 29. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Przeprowadzono reakcję, podczas której na drugorzędową chloropochodną alkanu podziałano odczynnikiem Gilmana. Wśród produktów reakcji obecny był 2-metylopropan.
Temperatura topnienia butylolitu (C4H9Li) jest znacznie niższa od 0 oC.
Na podstawie różnicy elektroujemności między litem a węglem oraz informacji wprowadzającej dotyczącej temperatury topnienia butylolitu określ rodzaj wiązania węgiel – lit.
Rysowanie wzorów grupowych - węglowodoru oraz produktu jego nitrowania. Zadanie 30.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
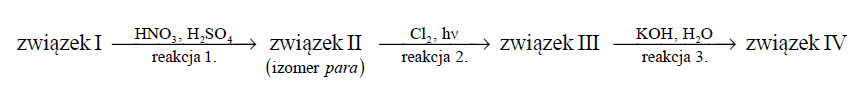
Związki II–IV są głównymi produktami organicznymi przemian opisanych schematem.
Napisz wzory półstrukturalne (grupowe) lub uproszczone związków I i II.
Określenie typów oraz mechanizmów reakcji chemicznych. Zadanie 30.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
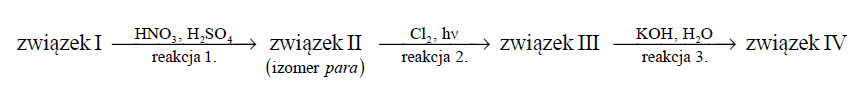
Związki II–IV są głównymi produktami organicznymi przemian opisanych schematem.
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji 2. i 3.
Zapis równania reakcji chemicznej chloropochodnej z wodnym roztworem KOH. Zadanie 30.3. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
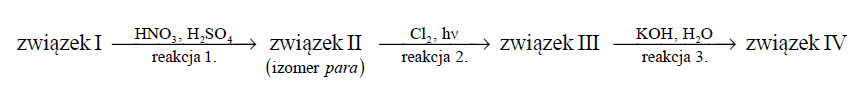
Związki II–IV są głównymi produktami organicznymi przemian opisanych schematem.
Napisz w formie cząsteczkowej równanie reakcji 3. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) lub uproszczonych.
Wybór związków chemicznych będących izomerami. Zadanie 31. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono wzory związków oznaczonych numerami 1–5.
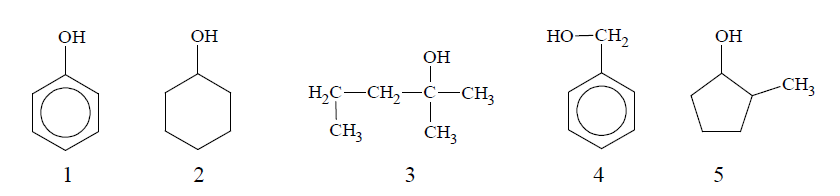
Spośród związków oznaczonych numerami 1–5 wybierz te, które są względem siebie izomerami. Napisz numery, którymi oznaczono te związki.
Zapis wzorów grupowych produktów łagodnego utleniania dwóch alkoholi tlenkiem miedzi(II). Zadanie 32. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono wzory związków oznaczonych numerami 1–5.

Uzupełnij poniższe schematy. Napisz wzór półstrukturalny (grupowy) lub uproszczony organicznego produktu reakcji tlenku miedzi(II):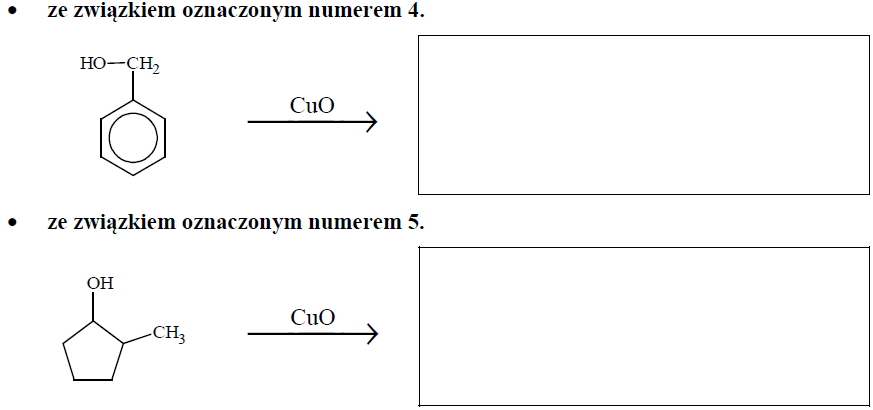
Wybór poprawnych określeń podczas porównania struktury cząsteczek witaminy D2 z witaminą D3. Zadanie 33. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Witamina D jest ogólną nazwą dla dwóch związków: witaminy D2 oraz witaminy D3 o podanych poniżej wzorach.
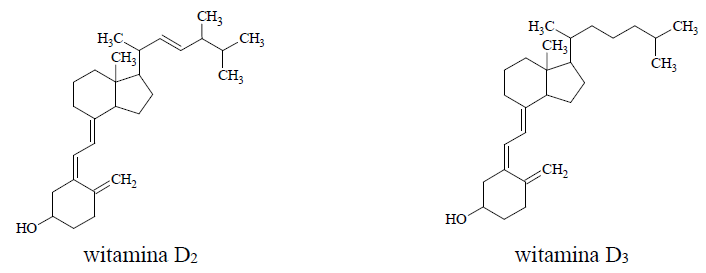
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. 1. Witamina D2 oraz witamina D3 są związkami organicznymi o podobnej strukturze, ale różnią się rodzajem łańcucha węglowodorowego przyłączonego do pierścienia (sześcioczłonowego / pięcioczłonowego). 2. Witamina D2 oraz witamina D3 (są / nie są) względem siebie izomerami. 3. W cząsteczce witaminy D2 oraz witaminy D3 (znajdują się / nie znajdują się) asymetryczne atomy węgla. 4. Po porównaniu budowy witaminy D2 oraz budowy witaminy D3 można stwierdzić, że liczba wiązań π w cząsteczce witaminy D2 jest (większa / mniejsza) niż liczba wiązań π w cząsteczce witaminy D3.
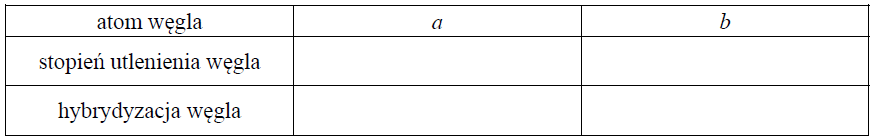
Wskazanie typu hybrydyzacji atomów węgla oraz ich stopni utlenienia. Zadanie 34. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Aktywne formy witaminy D, odgrywające ważną rolę w kontrolowaniu metabolizmu wapnia i fosforu, nie występują w pokarmie. Pod wpływem światła słonecznego obie aktywne formy są wytwarzane pod powierzchnią skóry w wyniku różnych przemian, np. reakcji fotochemicznej, reakcji polegającej na otwarciu pierścienia, izomeryzacji, a także przemian metabolicznych, np.:
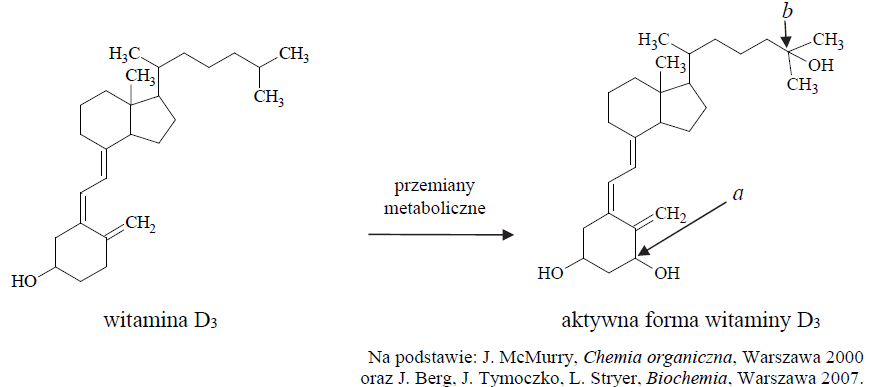
Podaj nazwę grup funkcyjnych, których wprowadzenie do szkieletu cząsteczki witaminy D3 skutkuje przekształceniem witaminy w jej aktywną formę. Określ formalne stopnie utlenienia atomów węgla oznaczonych w powyższym wzorze literami a i b oraz określ hybrydyzację orbitali walencyjnych atomów węgla oznaczonych tymi samymi literami. Uzupełnij tabelę. Nazwa: