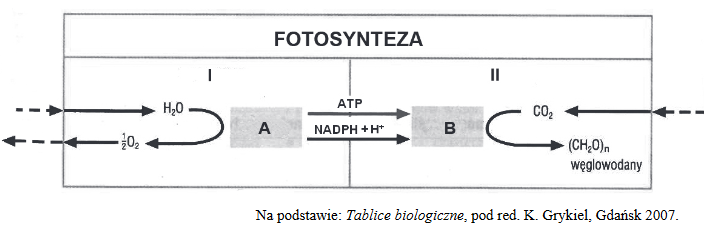
organizacja materii żywej na poziomie komórkowym
Na schemacie przedstawiono organizację materii żywej na poziomie komórkowym.

Poniżej podano przykłady elementów składających się na ten poziom organizacji życia.
A. aminokwasy
B. białka
C. jądro komórkowe
D. kwasy nukleinowe
E. mitochondrium
F. monosacharydy
G. tlen
H. węgiel
I. woda
Poszczególnym elementom (1–4) schematu przyporządkuj po dwa przykłady (A–I): wpisz poniżej ich oznaczenia literowe.
1. …..
2. …..
3. …..
4. …..
Wskazanie wielkości, których wzrost wskazują strzałki. Zadanie 1. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Na rysunku przedstawiono schemat układu okresowego pierwiastków (bez lantanowców i aktynowców), na którym umieszczono strzałki A i B odpowiadające kierunkom zmian
wybranych wielkości charakteryzujących pierwiastki chemiczne.
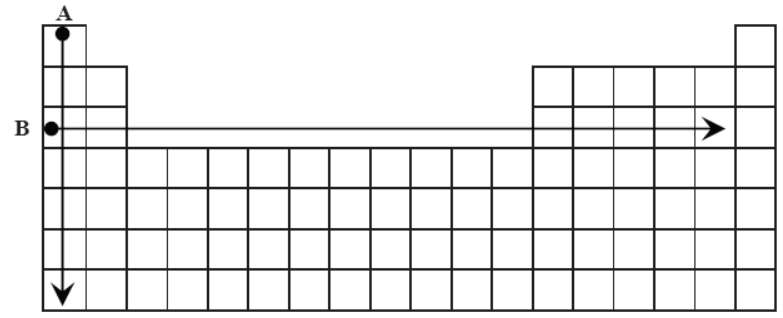
Podkreśl wszystkie wymienione poniżej wielkości, których wzrost wskazują strzałki oznaczone literami A i B. 1. Dla pierwiastków 1. grupy strzałka A wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego promienia jonowego. 2. Dla pierwiastków grup 1.–2. i 13.–17. okresu III strzałka B wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego charakteru metalicznego.
Ocena poprawności zdań dotyczących trzech pierwiastków chemicznych. Zadanie 2. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz III.
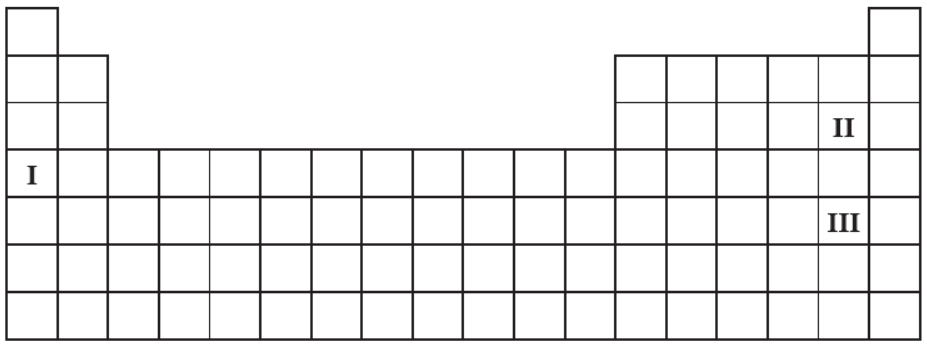
Wypełnij tabelę, wpisując literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa. 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje stopień utlenienia równy – I. 2. Atomy pierwiastka II mają silniejszą tendencję do przyłączania elektronu niż atomy pierwiastka III. W konsekwencji pierwiastek II jest silniejszym utleniaczem niż pierwiastek III. 3. Wodorki pierwiastków II oraz III, rozpuszczając się w wodzie, ulegają dysocjacji jonowej. Stała dysocjacji wodorku pierwiastka II jest większa od stałej dysocjacji wodorku pierwiastka III.
Wskazanie nazwy wielkości fizycznej. Zadanie 3a. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Na poniższym wykresie przedstawiono zależność pewnej makroskopowej wielkości charakteryzującej pierwiastki chemiczne w funkcji ich liczby atomowej Z.
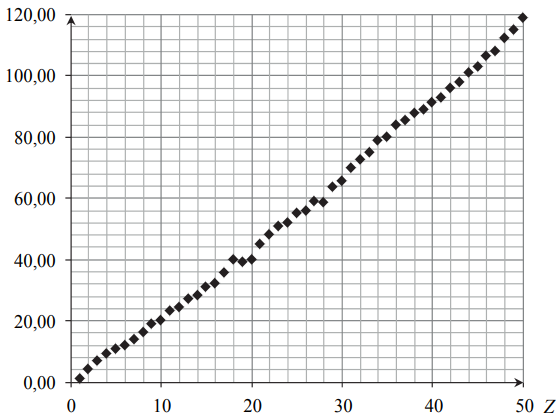
Opisz oś pionową wykresu, podając nazwę tej wielkości oraz jednostkę, w jakiej jest ona wyrażana.
Opis osi pionowej:
Wybór właściwej grupy pierwiastków. Zadanie 3b. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Pierwsza energia jonizacji E1 to najmniejsza energia potrzebna do oddzielenia pierwszego (o najwyższej energii) elektronu od atomu. Poniższy wykres przedstawia zależność pierwszej energii jonizacji atomów pierwiastków z czterech pierwszych okresów układu okresowego od liczby atomowej Z tych pierwiastków.
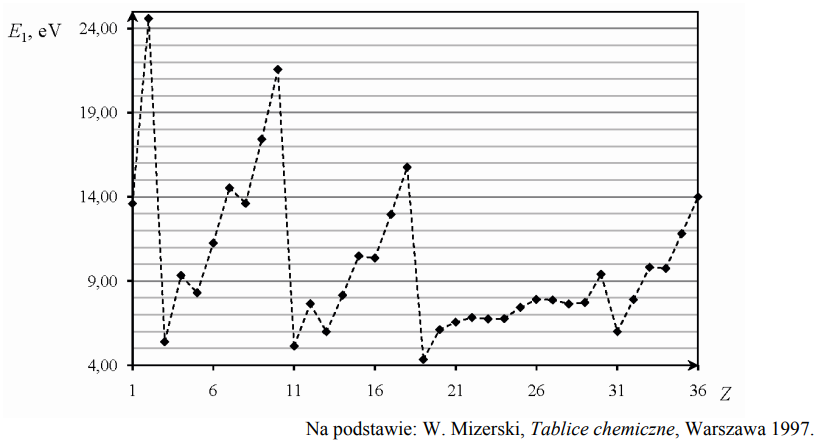
Uzupełnij zdanie. Wybierz i podkreśl numer grupy pierwiastków spośród podanych w nawiasie. W danym okresie układu okresowego największą wartość pierwszej energii jonizacji E1 mają pierwiastki (pierwszej / trzeciej / siedemnastej / osiemnastej) grupy.