Krzywe poniżej ilustrują zależności wartości pH od stężeń molowych roztworów trzech związków chemicznych oznaczonych kolejno literami X, Y oraz Z. Na osi odciętych zamiast wartości stężenia molowego roztworu (Co) umieszczono wartości –logCo. Na przykład dla wyrażenia –logCo = 3 stężenie molowe roztworu Co = 10–3 mol∙dm–3.
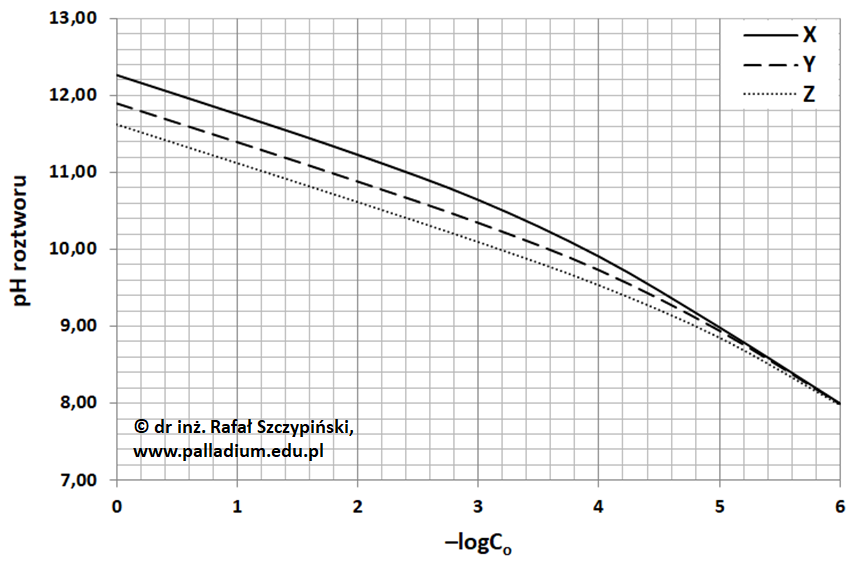
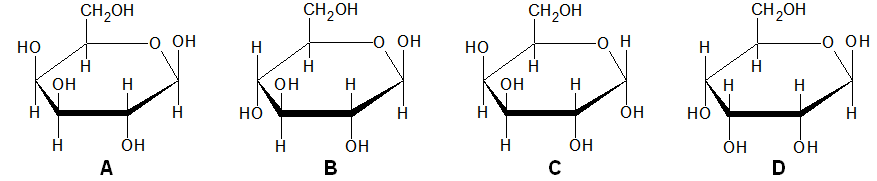
Z kwasem octowym związek chemiczny Z tworzy sól, której wodny roztwór w temperaturze 25 oC ma odczyn praktycznie obojętny. Dwa pozostałe związki są względem siebie izomerami oraz organicznymi pochodnymi związku Z.
Spektroskopia mas jest jedną z metod instrumentalnych służących do badania struktury związków organicznych. Znajdujące się w badanej próbce cząsteczki analizowanej substancji zostają poddane jonizacji oraz fragmentacji na mniejsze drobiny. Następnie rejestruje się widmo powstałych w wyniku fragmentacji jonów dodatnich, rozdzielonych w zależności od stosunku ich masy molowej do ładunku (m/z). Na przedstawionym w postaci graficznej obrazie widma widoczny jest zwykle również pik tzw. jonu molekularnego M+∙ powstającego w wyniku wybicia jednego elektronu z cząsteczki analizowanego związku chemicznego. W przypadku, gdy badana próbka jest substancją stanowiącą alifatyczną pochodną organiczną opisanego w informacji wprowadzającej związku chemicznego, zawierającego jedną grupę funkcyjną, w widmie masowym widoczny jest pik fragmentacyjny przypadający dla wartości m/z = 30. Jest on charakterystyczny, gdy w cząsteczce atom węgla połączony bezpośrednio z heteroatomem (atomem pierwiastka innym niż węgiel lub wodór) ma rzędowość nie większą niż I.
W celu ustalenia struktury cząsteczki związku chemicznego X zarejestrowano jego widmo masowe. Pik jonu molekularnego odpowiada wartości m/z równej 59.
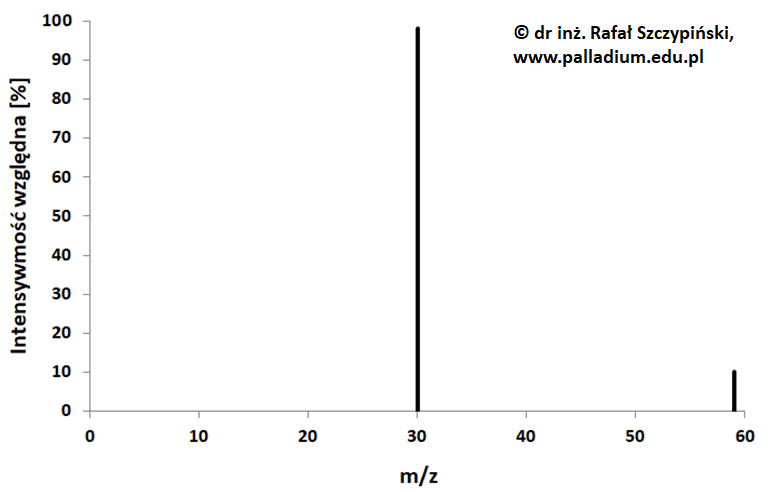
Na podstawie: R. M. Silverstein, F. X. Webster, D. J. Kiemle, Spektroskopowe metody identyfikacji związków organicznych, Warszawa 2012 oraz National Institute of Advanced Industrial Science and Technology, www.sdbs.db.aist.go.jp, dostęp od 2022 roku.
Cząsteczka związku X ma tylko jedną grupę alkilową, a pomiędzy cząsteczkami związku Y nie tworzą się wiązania wodorowe.
Wyjaśnij, dlaczego pomiędzy cząsteczkami związku Y nie tworzą się wiązania wodorowe?
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone