Wskazanie związków chemicznych o budowie jonowej. Zadanie 3. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Poniżej podano wzory pięciu związków chemicznych.
Podkreśl te wzory, które przedstawiają związki chemiczne występujące w postaci kryształów jonowych (tak jak chlorek sodu), a nie zbiorów cząsteczek. CCl4 Li2O SO2 CS2 BaBr2
Zapis równania otrzymywania tlenku wskazaną metodą. Zadanie 4. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Chlor tworzy tlenki, w których przyjmuje różne stopnie utlenienia. Tlenek, w którym chlor występuje na najwyższym stopniu utlenienia, otrzymuje się w reakcji odwodnienia (dehydratacji) kwasu chlorowego zawierającego chlor na tym samym stopniu utlenienia.
Napisz równanie reakcji otrzymywania tego tlenku powyższą metodą.
Wskazanie wartości ciśnienia. Zadanie 5a. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Podaj wartość ciśnienia panującego w zbiorniku z substancją Y.
Obliczanie wartości ciśnienia po zmianie temperatury. Zadanie 5b. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Oblicz, jaką wartość osiągnie ciśnienie w zbiorniku z substancją X, jeśli temperatura wzrośnie w nim o 100,0 K. Stała gazowa R = 83,1 dm3·hPa·mol–1·K–1. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Wskazanie gazu o większej gęstości. Zadanie 6. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Wskaż gaz (X lub Y), który ma większą gęstość w warunkach normalnych.
Rysowanie wykresu zależności rozpuszczalności KCl w wodzie od temperatury. Zadanie 7. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
Stężenie procentowe nasyconego wodnego roztworu chlorku potasu o temperaturze 20 oC wynosi 25,37% masowych. Rozpuszczalność w wodzie tego związku w temperaturze 40 oC jest równa 40 g/100 g wody. W przedziale od 0 oC do 50 oC zależność rozpuszczalności chlorku potasu od temperatury jest liniowa.
Korzystając z powyższych informacji, uzupełnij tabelę, a następnie narysuj wykres zależności rozpuszczalności chlorku potasu w wodzie od temperatury w przedziale od 0 oC do 50 oC. 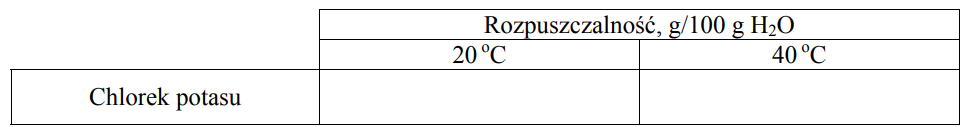
Obliczanie stężenia procentowego roztworu kwasu solnego. Zadanie 8. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W 1,00 dm3 wody rozpuszczono 112,00 dm3 chlorowodoru odmierzonego w warunkach normalnych.
Oblicz stężenie procentowe otrzymanego kwasu solnego w procentach masowych. Załóż, że gęstość wody wynosi 1,00 g·cm–3. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Wskazanie barwy kwiatów rośliny wraz z uzasadnieniem. Zadanie 9ab. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
Pewna roślina rosnąca na glebie o odczynie kwasowym ma kwiaty w kolorze niebieskim, a gdy odczyn gleby jest zasadowy, jej kwiaty mają zabarwienie różowoczerwone. Gleba, na której posadzono tę roślinę, pierwotnie miała odczyn obojętny, ale do jej użyźnienia
zastosowano siarczan(VI) amonu.
a) Określ kolor, na jaki zabarwiły się kwiaty tej rośliny po użyciu siarczanu(VI) amonu. Kwiaty zabarwiły się na kolor: b) Uzasadnij swoją odpowiedź, zapisując w formie jonowej skróconej odpowiednie równanie reakcji. Równanie reakcji:
Wskazanie sprzężonych par kwas-zasada Brønsteda. Zadanie 10. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W teorii Brønsteda sprzężoną parą kwas-zasada nazywa się układ złożony z kwasu oraz zasady, która powstaje z tego kwasu przez odłączenie protonu.
Dla przemiany przedstawionej równaniem: CH3NH2 + H2O ⇄ CH3NH3+ + OH– napisz wzory kwasów i zasad, które w tej reakcji tworzą sprzężone pary.
Uszeregowanie kwasów karboksylowych według rosnącej mocy. Zadanie 11. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W poniższej tabeli podano wartości stopnia dysocjacji trzech kwasów karboksylowych w ich wodnych roztworach o stężeniu 0,1 mol/dm3 w temperaturze 25 oC.
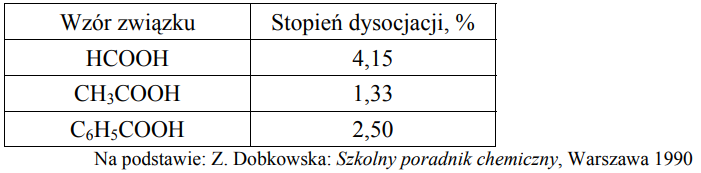
Na podstawie podanych wartości stopnia dysocjacji uszereguj podane kwasy od najsłabszego do najmocniejszego.
Zapis równań reakcji chemicznych kwasów z solami. Zadanie 12a. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Przygotowano wodne roztwory kwasów HX i HY oraz ich soli NaX i NaY, wszystkie o stężeniach 1 mol/dm3 . Stałe dysocjacji kwasowej HX i HY w temperaturze 25 oC są odpowiednio równe: Ka(HX) = 4,0·10-5, Ka(HY) = 2,3·10-2.
Posługując się zapisem w formie cząsteczkowej, dopisz do podanych substratów produkty reakcji lub napisz, że przemiana nie zachodzi. NaX + HY → NaY + HX →
Wskazanie kwasu, którego wodny roztwór ma wyższe pH. Zadanie 12b. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Przygotowano wodne roztwory kwasów HX i HY oraz ich soli NaX i NaY, wszystkie o stężeniach 1 mol/dm3 . Stałe dysocjacji kwasowej HX i HY w temperaturze 25 oC są odpowiednio równe: Ka(HX) = 4,0·10-5, Ka(HY) = 2,3·10-2.
Wskaż kwas (HX lub HY), którego roztwór o stężeniu 1 mol/dm3 ma wyższe pH.
Wyjaśnienie, dlaczego stała dysocjacji lepiej charakteryzuje moc elektrolitu. Zadanie 13. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Do oceny mocy elektrolitu stosuje się stopień dysocjacji oraz stałą dysocjacji, jednak w tablicach chemicznych zwykle podawane są wartości stałej dysocjacji.
Wyjaśnij, dlaczego stała dysocjacji lepiej charakteryzuje moc elektrolitu.
Obliczanie stężenia równowagowego pary wodnej. Zadanie 14. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W temperaturze 700 K stężeniowa stała równowagi reakcji opisanej równaniem:
CO (g)+ H2O (g) ⇄ CO2 (g)+ H2 (g)
ma wartość 9,0. Do reakcji tej użyto pary wodnej (H2O) oraz gazu syntezowego, czyli mieszaniny CO i H2, zamiast czystego CO. Reakcję prowadzono w układzie zamkniętym. Po osiągnięciu stanu równowagi w temperaturze 700 K stężenia CO, CO2, H2 były odpowiednio równe: [CO] = 0,3 mol/dm3 , [CO2] = 6,3 mol/dm3 , [H2] = 12,9 mol/dm3.
Oblicz stężenie równowagowe pary wodnej w temperaturze 700 K. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Obliczanie stosunku molowego tlenku węgla(II) oraz wodoru użytych do reakcji. Zadanie 15. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W temperaturze 700 K stężeniowa stała równowagi reakcji opisanej równaniem:
CO (g)+ H2O (g) ⇄ CO2 (g)+ H2 (g)
ma wartość 9,0. Do reakcji tej użyto pary wodnej (H2O) oraz gazu syntezowego, czyli mieszaniny CO i H2, zamiast czystego CO. Reakcję prowadzono w układzie zamkniętym. Po osiągnięciu stanu równowagi w temperaturze 700 K stężenia CO, CO2, H2 były odpowiednio równe: [CO] = 0,3 mol/dm3 , [CO2] = 6,3 mol/dm3 , [H2] = 12,9 mol/dm3.
Korzystając z podanych w informacji wartości stężeń równowagowych reagentów, oblicz i napisz, w jakim stosunku molowym występowały CO i H2 w gazie syntezowym użytym do realizacji opisanej przemiany.

