Uszeregowanie związków chemicznych zgodnie ze wzrostem ich lotności. Zadanie 3b. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pomiędzy cząsteczkami, w których obecne są atomy wodoru związane bezpośrednio z silnie elektroujemnymi atomami niemetalu (fluoru, tlenu, azotu), tworzą się wiązania wodorowe mające wpływ na właściwości fizyczne związku.
Wiązania wodorowe utrudniają przejście związku w stan gazowy, ponieważ powodują asocjację cząsteczek – łączenie się ich w większe agregaty. Wiązania te są tym silniejsze, im bardziej elektroujemny jest atom niemetalu będący donorem pary elektronowej.
Uszereguj związki o wzorach: CH3CH3, CH3NH2, CH3OH zgodnie ze wzrastającą lotnością (od najmniejszej do największej).
Ocena poprawności zdań dotyczących energii jonizacji pierwiastków chemicznych. Zadanie 4. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej) to minimalna energia potrzebna do oderwania jednego elektronu od obojętnego atomu. Na poniższym wykresie przedstawiono zmiany pierwszej energii jonizacji pierwiastków uszeregowanych według liczb atomowych.
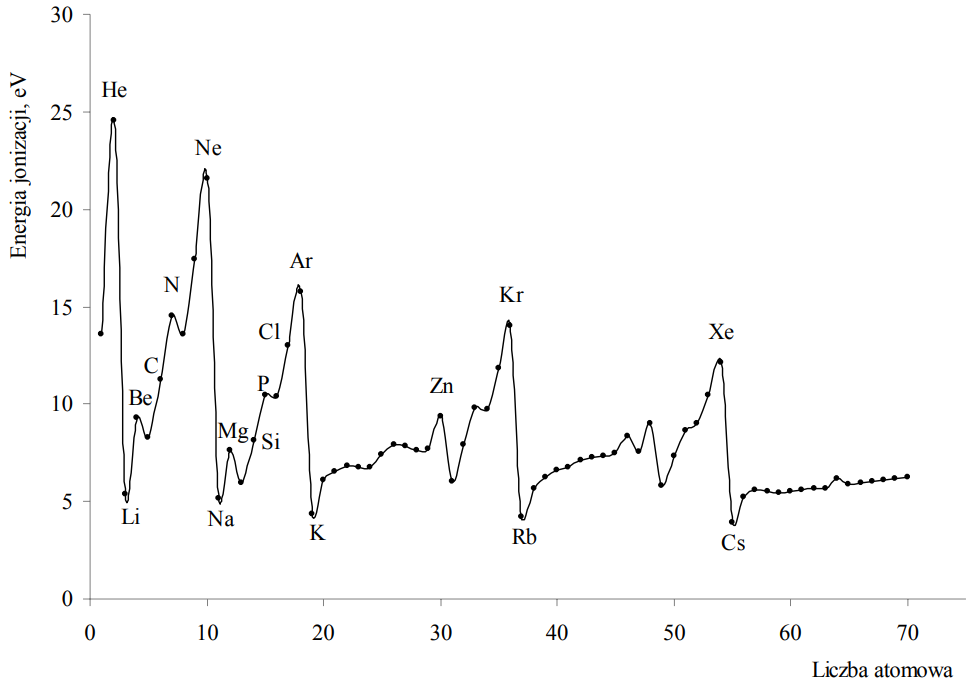
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe. 1. W szeregu pierwiastków: lit, beryl, węgiel i azot wraz ze wzrostem liczby atomowej obserwujemy zależność polegającą na tym, że im więcej elektronów 2. W szeregu pierwiastków: hel, neon, argon, krypton i ksenon wraz ze wzrostem liczby atomowej obserwujemy zwiększanie się promienia atomowego i wzrost wartości pierwszej energii jonizacji. 3. Magnez ma mniejszy promień atomowy niż glin i większą wartość pierwszej energii jonizacji.
znajduje się na powłoce zewnętrznej, tym większa jest wartość pierwszej energii jonizacji.
Zapis równania reakcji jądrowej powstawania trytu. Zadanie 5. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β–. Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6·104 atomów trytu.
Napisz równanie reakcji wytwarzania trytu w wyższych warstwach atmosfery. Uzupełnij poniższy schemat.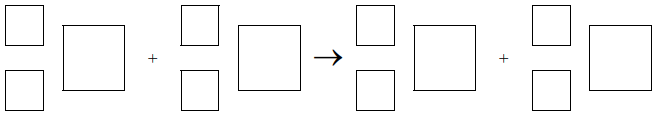
Określenie liczby atomów trytu w jednym litrze wody. Zadanie 6. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β–. Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6·104 atomów trytu.
Podaj w przybliżeniu, w ilu dm3 wody będącej w naturalnym obiegu znajduje się 1 mol atomów trytu.
Określenie liczby atomów trytu pozostałych w próbce po 40 latach. Zadanie 7. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β–. Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6·104 atomów trytu.
Próbkę wody o objętości 10 cm3 umieszczono w naczyniu i szczelnie zamknięto.
Na podstawie poniższego wykresu przedstawiającego zależność liczby atomów trytu w 1 cm3 wody od czasu oszacuj, ile atomów trytu pozostanie w próbce wody o objętości 10 cm3 po 40 latach. Po 40 latach w próbce pozostanie około atomów trytu.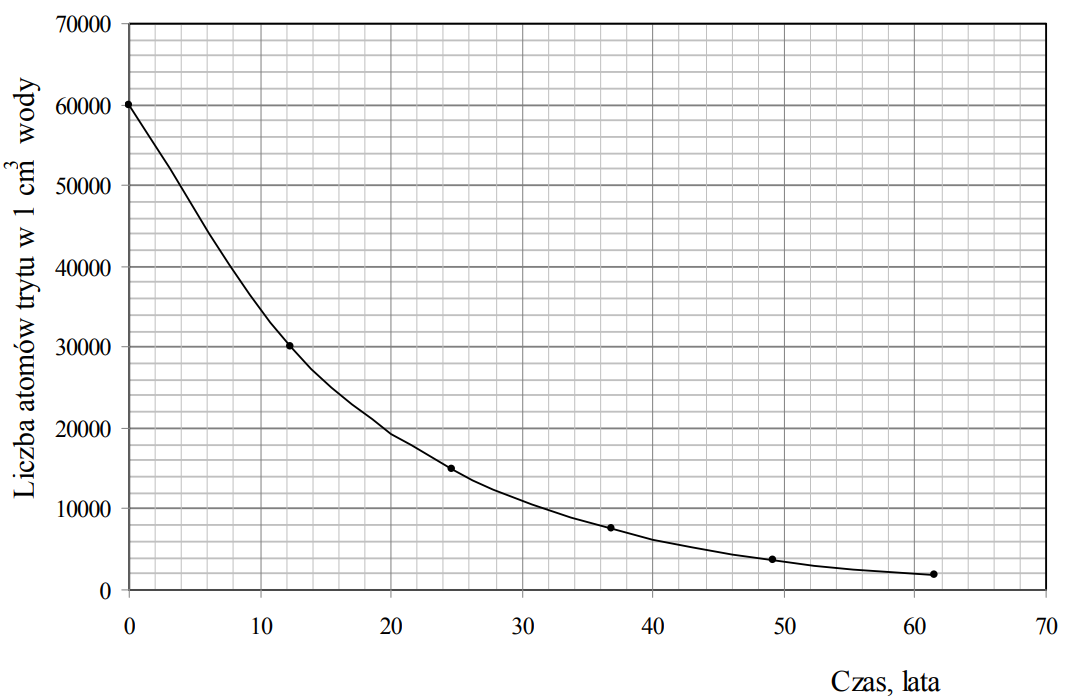
Obliczanie stężenia procentowego sacharozy po przerwaniu reakcji hydrolizy. Zadanie 8. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Sporządzono 200 g roztworu zawierającego 100 g sacharozy. Sacharozę poddano reakcji hydrolizy:
![]()
Reakcję przerwano w momencie, gdy całkowite stężenie cukrów redukujących w roztworze było równe 40% masowych.
Oblicz stężenie sacharozy, wyrażone w procentach masowych, w roztworze po przerwaniu reakcji. W obliczeniach przyjmij przybliżone wartości mas molowych:![]()
Zapis wzoru sprzężonego kwasu Brønsteda oraz wzoru sprzężonej zasady Brønsteda. Zadanie 9a. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Zgodnie z teorią Brønsteda kwas i sprzężona z nim zasada różnią się o jeden proton, przy czym im silniejszy jest kwas, tym słabsza jest sprzężona z nim zasada.
Uzupełnij poniższą tabelę, wpisując wzory brakującej sprzężonej zasady i brakującego sprzężonego kwasu.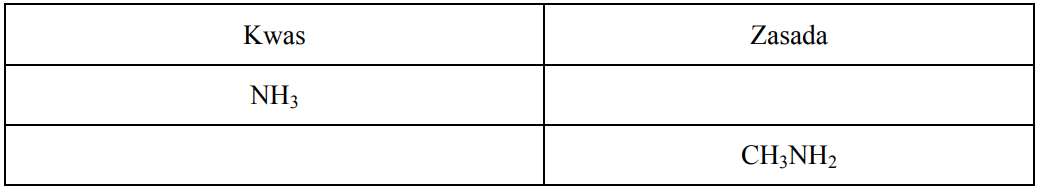
Wskazanie najsłabszej zasady Brønsteda. Zadanie 9b. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Zgodnie z teorią Brønsteda kwas i sprzężona z nim zasada różnią się o jeden proton, przy czym im silniejszy jest kwas, tym słabsza jest sprzężona z nim zasada.
Korzystając z zamieszczonej powyżej informacji, wskaż najsłabszą spośród następujących zasad: Cl–, HS–, CH3COO–, C6H5O–. Najsłabszą zasadą jest:
Uszeregowanie kwasów karboksylowych według wzrastającej mocy. Zadanie 10a. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Zmierzono pH wodnych roztworów czterech soli o stężeniu 0,01 mol·dm–3 i wyniki zestawiono w poniższej tabeli.
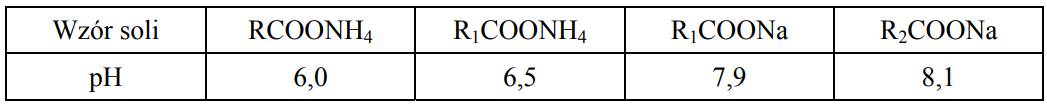
Na podstawie: A. Hulanicki, Reakcje kwasów i zasad w chemii analitycznej, Warszawa 1992
Uszereguj kwasy RCOOH, R1COOH, R2COOH od najsłabszego do najmocniejszego.
Zapis równania procesu hydrolizy przebiegającego w roztworze soli sodowej kwasu karboksylowego. Zadanie 10b. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Zmierzono pH wodnych roztworów czterech soli o stężeniu 0,01 mol·dm–3 i wyniki zestawiono w poniższej tabeli.

Na podstawie: A. Hulanicki, Reakcje kwasów i zasad w chemii analitycznej, Warszawa 1992
Napisz w formie jonowej skróconej równanie reakcji hydrolizy soli o wzorze R2COONa.
Przypisanie wzorów związków chemicznych do numerów probówek. Zadanie 11a. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W probówkach 1–4 znajdują się (w nieznanej kolejności) wodne roztwory następujących substancji: AgNO3, BaCl2, ZnSO4, NaCl. W celu zidentyfikowania zawartości probówek zbadano odczyn wodnego roztworu każdej soli oraz zmieszano kolejno ze sobą roztwory z poszczególnych probówek. Wyniki przeprowadzonych doświadczeń zapisano w poniższej tabeli.

Korzystając z powyższej informacji, napisz wzory substancji znajdujących się w probówkach 1–4. 1.: 2.: 3.: 4.:
Zapis równań reakcji chemicznych. Zadanie 11b. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
W probówkach 1–4 znajdują się (w nieznanej kolejności) wodne roztwory następujących substancji: AgNO3, BaCl2, ZnSO4, NaCl. W celu zidentyfikowania zawartości probówek zbadano odczyn wodnego roztworu każdej soli oraz zmieszano kolejno ze sobą roztwory z poszczególnych probówek. Wyniki przeprowadzonych doświadczeń zapisano w poniższej tabeli.

Napisz w formie jonowej skróconej równania reakcji, które umożliwiły identyfikację substancji znajdującej się w probówce 3. Równania reakcji:
Obliczanie liczby moli reagenta użytego w reakcji równowagowej. Zadanie 12. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W reaktorze o objętości 1 dm3 przebiegła przemiana zgodnie z równaniem A + B ⇄ C + D. Do reakcji użyto 2 mole substancji A i nadmiar substancji B. Po ustaleniu się stanu równowagi stwierdzono, że w mieszaninie poreakcyjnej znajduje się 0,4 mola substancji A. Stała równowagi tej reakcji w temperaturze prowadzenia procesu jest równa 1.
Oblicz, ile moli substancji B użyto do tej reakcji. Wynik podaj z dokładnością do liczby całkowitej.
Ocena wpływu zmiany ciśnienia i temperatury na wydajność reakcji. Zadanie 13ab. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Na poniższym wykresie zilustrowano zmianę energii podczas przebiegu reakcji opisanej równaniem
A (s) + AB2 (g) ⇄ 2AB (g).
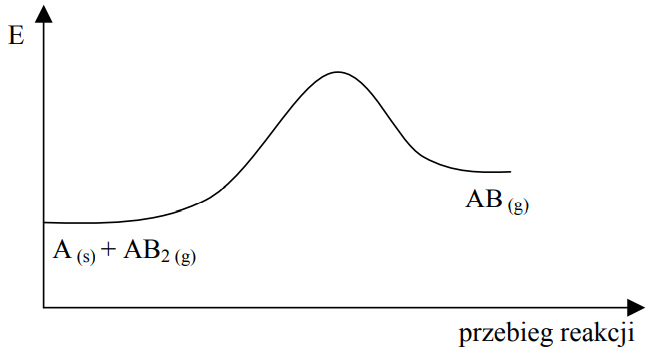
Oceń, jak zmieni się (wzrośnie czy zmaleje) wydajność reakcji otrzymywania produktu AB, jeżeli w układzie będącym w stanie równowagi nastąpi a) wzrost temperatury w warunkach izobarycznych (p = const). b) wzrost ciśnienia w warunkach izotermicznych (T = const).
Zapis równań reakcji połówkowych utleniania oraz redukcji. Zadanie 14abc. Arkusz CKE chemia maj 2011 rozszerzony (4 punkty)
Poniżej przedstawiony jest schemat reakcji:
![]()
a) Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas tej przemiany. Równanie reakcji redukcji: Równanie reakcji utleniania: b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie. c) Napisz, jakie funkcje pełnią jony MnO42– w tej reakcji.![]()

