Usuwanie gazowego, dobrze rozpuszczalnego produktu z mieszaniny poreakcyjnej
Reakcja sproszkowanego węglanu amonu z rozcieńczonym kwasem siarkowym(VI) przebiega bardzo gwałtownie, o czym świadczy intensywnie wydzielający się gaz. Działając na ten sam związek chemiczny wodnym roztworem wodorotlenku sodu nie obserwujemy pęcherzyków wydzielającego się gazu. Rodzaj gazowego produktu można wówczas zidentyfikować trzymając u wylotu naczynia zwilżony wodą papierek wskaźnikowy.
W jaki sposób można ze względnie wysoką wydajnością usunąć amoniak z mieszaniny poreakcyjnej? Uzasadnij odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej będącej podstawą odróżnienia próbek kainitu oraz karnalitu
Do minerałów o stosunkowo dużej zawartości magnezu należą – kainit, o wzorze KCl·MgSO4·3H2O oraz karnalit – KCl·MgCl2·6H2O.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W dwóch różnych probówkach losowo umieszczono próbki kainitu oraz karnalitu. W celu odróżnienia zawartości każdej z nich, próbki całkowicie rozpuszczono w wodzie, a następnie wykonano doświadczenie chemiczne podczas którego wykorzystano jeden z odczynników:
NaBr(aq), KOH(aq), AgNO3(aq), BaCl2(aq).
Napisz w formie jonowej skróconej równanie reakcji chemicznej stanowiącej podstawę odróżnienia próbek. Napisz, co zaobserwowano w każdej z probówek? Równanie reakcji: Obserwacje (próbka kainitu): Obserwacje (próbka karnalitu): © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej jaka doprowadziła do powstania ciemniejącego osadu
Do minerałów o stosunkowo dużej zawartości magnezu należą – kainit, o wzorze KCl·MgSO4·3H2O oraz karnalit – KCl·MgCl2·6H2O.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Próbkę jednego z minerałów rozpuszczono w takiej ilości wody, że uzyskano roztwór o stosunkowo wysokim stężeniu znajdujących się w nim drobin. Następnie do tak uzyskanej mieszaniny wprowadzono jeden spośród odczynników: Pb(NO3)2(aq), AgNO3(aq), Ca(OH)2(aq), KOH(aq), CaBr2(aq). Zaobserwowano wówczas, że wytrącił się biały, serowaty osad, który z czasem stał się ciemniejszy. Napisz w formie jonowej skróconej równanie pierwszej reakcji chemicznej jaka przebiegła. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie szybszego odwodnienia mieszaniny hydratów umieszczonej na płytce ceramicznej
Z pojemnika zawierającego 250 g mieszaniny dwóch hydratów: CuSO4 · 3H2O oraz CuSO4 · 5H2O odważono dwie próbki o masie 7,32 g każda. Pierwszą z nich umieszczono w tyglu porcelanowym, a drugą rozłożono równomiernie na ceramicznej płytce wykonanej z tego samego materiału, co tygiel. Obie próbki wprowadzono do pieca i poddano całkowitemu odwodnieniu w temperaturze 170 oC. Po zakończeniu doświadczenia stwierdzono, że masy uzyskanych w obu naczyniach białych substancji stałych stanowiły po 65,6% masy każdej z mieszanin poddanych prażeniu.
Podczas przeprowadzonego eksperymentu stwierdzono, że jedna z próbek szybciej osiągnęła stałą masę.
Określ, która była to próbka? Uzasadnij swoją odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie wzoru sumarycznego, modelu hybrydyzacji i liczby wiązań σ oraz π. Zadanie 1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Dwa pierwiastki oznaczono umownie literami X i Z. Dwuujemny jon pierwiastka Z ma konfigurację elektronową 1s22s22p63s23p6 w stanie podstawowym. Pierwiastki X i Z tworzą związek XZ2, w którym stosunek masowy pierwiastka X do pierwiastka Z jest równy 3 : 16. Cząsteczka tego związku ma budowę liniową.
Napisz wzór sumaryczny związku opisanego w informacji, zastępując umowne oznaczenia X i Z symbolami pierwiastków. Podaj typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu pierwiastka X tworzącego związek XZ2 oraz napisz liczbę wiązań typu σ i liczbę wiązań typu π występujących w cząsteczce opisanego związku chemicznego. Wzór sumaryczny: Typ hybrydyzacji: Liczba wiązań typu σ: Liczba wiązań typu π:
Ocena poprawności zdań na podstawie diagramu fazowego tlenku węgla(IV). Zadanie 2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Poniższy diagram fazowy tlenku węgla(IV) przedstawia wartości temperatury i ciśnienia, w których CO2 występuje w różnych fazach: w stanie stałym, ciekłym lub gazowym. Linie ciągłe określają warunki temperatury i ciśnienia, w których istnieje trwała równowaga między dwiema fazami. W punkcie oznaczonym symbolem P3 (T = 216 K i p = 5100 hPa) CO2 występuje w trzech fazach znajdujących się w stanie równowagi.
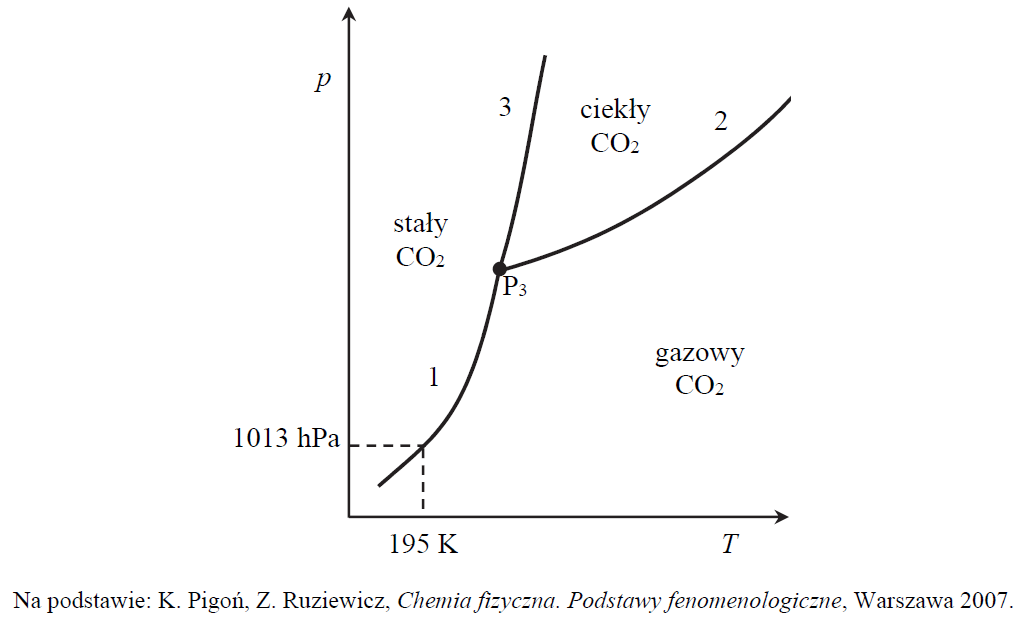
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Pod ciśnieniem wyższym od 5100 hPa tlenek węgla(IV) nie występuje w ciekłym stanie skupienia. 2. W temperaturze 195 K i pod ciśnieniem 1013 hPa stały tlenek węgla(IV) może ulegać sublimacji. 3. Zmianę wartości temperatury topnienia tlenku węgla(IV) w zależności od ciśnienia ilustruje krzywa oznaczona numerem 2.
Wybór poprawnych określeń dotyczących różnych rodzajów kryształów. Zadanie 3. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Uzupełnij poniższe zdania dotyczące czterech różnych rodzajów kryształów. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
W kryształach metalicznych sieć krystaliczna zbudowana jest z (atomów / cząsteczek / kationów i anionów / kationów metali) otoczonych chmurą zdelokalizowanych elektronów. Elementami, z których zbudowana jest sieć krystaliczna tlenku wapnia, są (atomy / cząsteczki / kationy i aniony). W kryształach molekularnych dominują oddziaływania międzycząsteczkowe, a w kryształach kowalencyjnych atomy tworzące sieć krystaliczną połączone są wiązaniami kowalencyjnymi. Przykładem kryształu molekularnego jest kryształ (chlorku sodu / sacharozy / wapnia), a przykładem kryształu kowalencyjnego – kryształ (diamentu / jodu / węglanu wapnia).
Zapis równania reakcji jonu tlenkowego z cząsteczką wody. Zadanie 4. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Wybór poprawnych określeń dotyczących anionu tlenkowego oraz tlenków. Zadanie 5. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastków mających (małą / dużą) elektroujemność i należących do grup układu okresowego o numerach: (1 i 2 / 14 i 15 / 16 i 17). Ulegające reakcji z wodą tlenki tych pierwiastków tworzą roztwory o silnie (kwasowym / zasadowym) odczynie, a więc o (niskim / wysokim) pH.
Ocena poprawności zdań dotyczących równowagowych reakcji metanu z parą wodną. Zadanie 6. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W przemyśle wodór można otrzymać w procesie konwersji metanu będącego głównym składnikiem gazu ziemnego. W mieszaninie gazu ziemnego i pary wodnej w pewnej temperaturze T i w obecności katalizatora niklowego zachodzą m.in. reakcje opisane poniższymi równaniami.
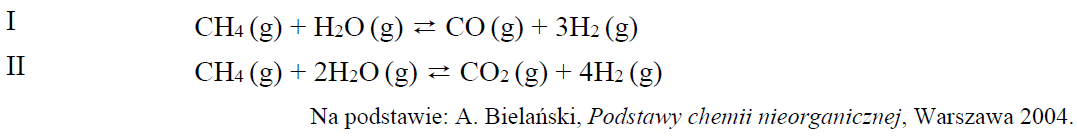
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Obniżenie ciśnienia w warunkach izotermicznych (T = const) w reaktorze skutkuje wzrostem wydajności otrzymywania wodoru w reakcjach I i II. 2. Wzbogacenie gazu ziemnego metanem skutkuje spadkiem wydajności otrzymywania wodoru w reakcjach I i II. 3. Gdy do mieszaniny reakcyjnej w stanie równowagi wprowadzi się katalizator niklowy, to nastąpi wzrost wydajności otrzymywania wodoru w reakcjach I i II. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem:
Obliczanie liczby moli wodoru w stanie równowagi. Zadanie 7. Arkusz CKE chemia maj 2019 rozszerzony (2 punkty)
W reaktorze o stałej pojemności znajdowały się tlenek węgla(II) i para wodna zmieszane w stosunku masowym 1 : 1, a sumaryczna liczba moli tych reagentów była równa 20. Stężeniowa stała równowagi reakcji
CO (g) + H2O (g) ⇄ CO2 (g) + H2 (g)
w warunkach prowadzenia procesu wynosi 1.
Oblicz, ile moli wodoru znajdowało się w reaktorze po osiągnięciu stanu równowagi przez układ.
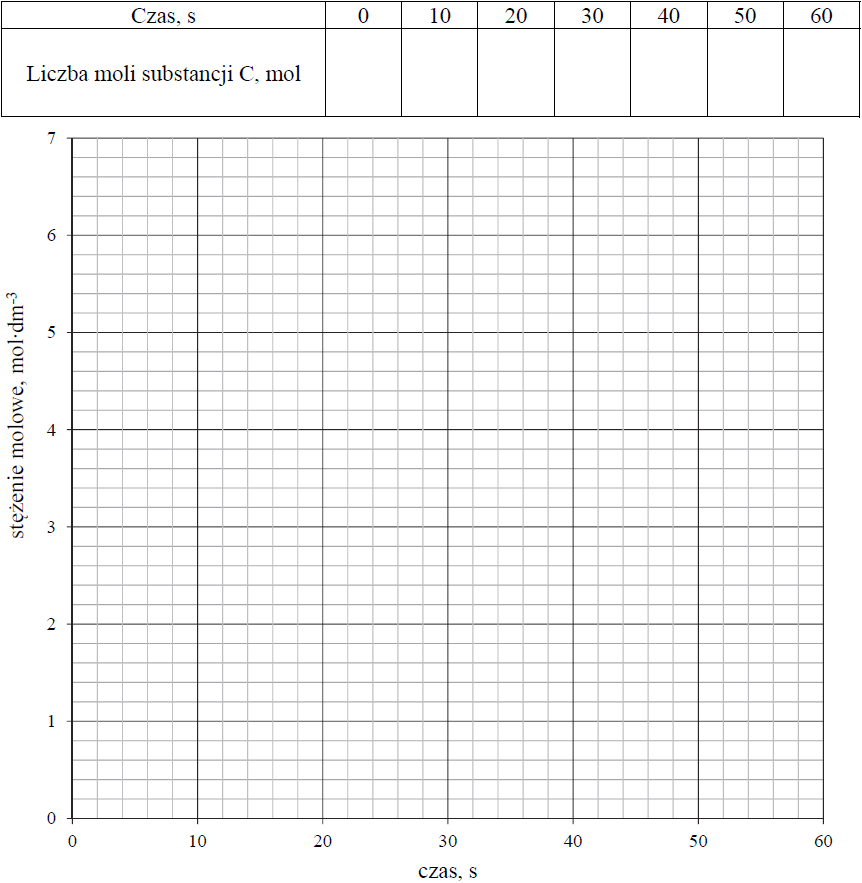
Obliczanie zmian liczby moli substratu w czasie oraz graficzne przedstawienie tych zmian. Zadanie 8. Arkusz CKE chemia maj 2019 rozszerzony (2 punkty)
W zamkniętym reaktorze o pojemności 1 dm3 znajdowały się gazowe substancje A i B zmieszane w stosunku stechiometrycznym. Reagenty ogrzano do temperatury T i zainicjowano reakcję przebiegającą zgodnie z poniższym schematem.
A (g) + 2B (g) ⇄ 3C (g) + D (g)
Przez jedną minutę, co 10 sekund, oznaczano liczbę moli substancji A w mieszaninie reakcyjnej. Wyniki zestawiono w poniższej tabeli.
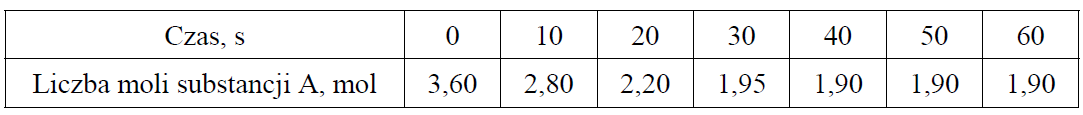
Uzupełnij poniższą tabelę, a następnie narysuj wykres przedstawiający zależność stężenia substancji C od czasu trwania reakcji, czyli w przedziale <0 s , 60 s>.