Otrzymywanie stałego produktu reakcji rozkładu dwuchromianu(VI) amonu bez domieszek pozostałych reagentów
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Zaproponuj, co należałoby zrobić, w celu otrzymania 7,6 g tlenku chromu(III) bez jakichkolwiek domieszek pozostałych reagentów, jeśli wyjściowo dysponujemy 12,6 g dwuchromianu(VI) amonu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji wydzielania gazu z udziałem związków nieorganicznych
Przeprowadzono pięć reakcji chemicznych, do przebiegu których zastosowano stechiometryczne ilości reagentów. W pierwszym naczyniu znajdowało się mleko wapienne (wodna zawiesina wodorotlenku wapnia), w probówkach o numerach 2, 3 i 4 umieszczono stężone roztwory soli. W probówce nr 5 znajdował się rozcieńczony roztwór kwasu azotowego(V). Schemat opisanego doświadczenia zilustrowano poniższym rysunkiem:
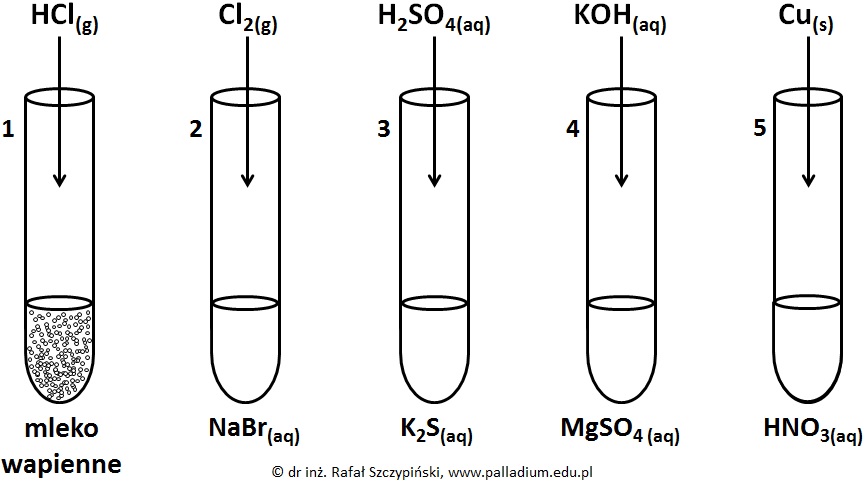
Napisz w formie jonowej skróconej równania tych reakcji chemicznych, w wyniku przebiegu których powstały substancje gazowe. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barw zawartości naczyń po zakończeniu doświadczenia przeprowadzonego z udziałem substancji nieorganicznych
Przeprowadzono pięć reakcji chemicznych, do przebiegu których zastosowano stechiometryczne ilości reagentów. W pierwszym naczyniu znajdowało się mleko wapienne (wodna zawiesina wodorotlenku wapnia), w probówkach o numerach 2, 3 i 4 umieszczono stężone roztwory soli. W probówce nr 5 znajdował się rozcieńczony roztwór kwasu azotowego(V). Schemat opisanego doświadczenia zilustrowano poniższym rysunkiem:

Podaj numery tych probówek, w których zaobserwowano zmiany barwy ich zawartości po dodaniu odczynnika. Napisz, na czym polegały te zmiany? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Reakcja roztworu wodorotlenku sodu z produktem reakcji kwasu ortofosforowego(V) z azotanem(III) sodu
Przeprowadzono dwa doświadczenia chemiczne pod ciśnieniem normalnym otoczenia i w stałej jego temperaturze.
Doświadczenie nr 1: do probówki ze sproszkowanym azotanem(III) sodu dodano niewielki nadmiar 25% roztworu kwasu ortofosforowego(V). Barwny, gazowy produkt, będący produktem reakcji częściowo opuścił naczynie reakcyjne.
Doświadczenie nr 2: po zakończeniu reakcji z doświadczenia nr 1, do jednej trzeciej pojemności probówki dodano nadmiar stężonego roztworu wodorotlenku sodu. Następnie probówkę szczelnie zamknięto i kilka razy wstrząśnięto energicznie bez otwierania. Na koniec zawartość naczynia doprowadzono do temperatury otoczenia.
Jaką barwę miała zawartość probówki po zakończeniu doświadczenia nr 2? Odpowiedź uzasadnij równaniem reakcji chemicznej, jeśli w wyniku jej przebiegu powstaje mieszanina soli dwóch kwasów tlenowych oraz woda. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone


