Obliczanie stężenia molowego jonów wapnia na podstawie potencjału półogniwa chlorosrebrowego (ogniwa)
Przykładem elektrody halogenosrebrowej jest elektroda chlorosrebrowa:
AgCl(s) + ē ⇄ Ag(s) + Cl–(aq)
Elektrodę taką stanowi srebrny drucik pokryty trudno rozpuszczalnym w wodzie chlorkiem srebra, zanurzony w roztworze zawierającym jony chlorkowe. Potencjał redoks tej elektrody zależy od stężenia jonów chlorkowych, co w temperaturze 298 K ilustruje zależność:
EAg/AgCl = EoAg/AgCl – 0,059∙log[Cl–]
W temperaturze 298 K potencjał standardowy (EoAg/AgCl) tej elektrody wynosi 0,222 V.
Na podstawie: W. Szczepaniak, Metody instrumentalne w analizie chemicznej, Warszawa 2012.
W roztworze chlorku wapnia o nieznanym stężeniu zanurzono drucik srebrny pokryty chlorkiem srebra. Potencjał redoks utworzonego w ten sposób półogniwa chlorosrebrowego w temperaturze 298 K wynosi 0,299 V.
Oblicz stężenie molowe jonów Ca2+ znajdujących się w roztworze. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Otrzymywanie stałego produktu reakcji rozkładu dwuchromianu(VI) amonu bez domieszek pozostałych reagentów
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Zaproponuj, co należałoby zrobić, w celu otrzymania 7,6 g tlenku chromu(III) bez jakichkolwiek domieszek pozostałych reagentów, jeśli wyjściowo dysponujemy 12,6 g dwuchromianu(VI) amonu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji wydzielania gazu z udziałem związków nieorganicznych
Przeprowadzono pięć reakcji chemicznych, do przebiegu których zastosowano stechiometryczne ilości reagentów. W pierwszym naczyniu znajdowało się mleko wapienne (wodna zawiesina wodorotlenku wapnia), w probówkach o numerach 2, 3 i 4 umieszczono stężone roztwory soli. W probówce nr 5 znajdował się rozcieńczony roztwór kwasu azotowego(V). Schemat opisanego doświadczenia zilustrowano poniższym rysunkiem:
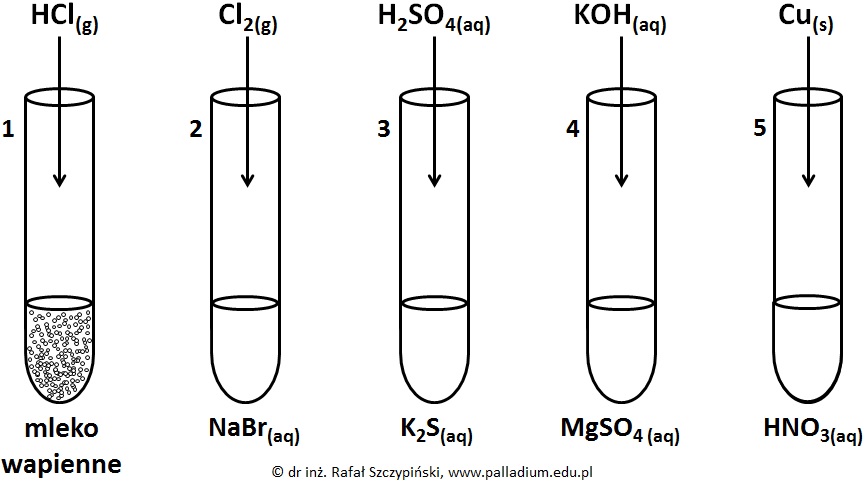
Napisz w formie jonowej skróconej równania tych reakcji chemicznych, w wyniku przebiegu których powstały substancje gazowe. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barw zawartości naczyń po zakończeniu doświadczenia przeprowadzonego z udziałem substancji nieorganicznych
Przeprowadzono pięć reakcji chemicznych, do przebiegu których zastosowano stechiometryczne ilości reagentów. W pierwszym naczyniu znajdowało się mleko wapienne (wodna zawiesina wodorotlenku wapnia), w probówkach o numerach 2, 3 i 4 umieszczono stężone roztwory soli. W probówce nr 5 znajdował się rozcieńczony roztwór kwasu azotowego(V). Schemat opisanego doświadczenia zilustrowano poniższym rysunkiem:

Podaj numery tych probówek, w których zaobserwowano zmiany barwy ich zawartości po dodaniu odczynnika. Napisz, na czym polegały te zmiany? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone


