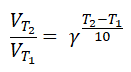Obliczanie stężenia molowego określonego jonu po zakończeniu pracy ogniwa zbudowanego z półogniw pierwszego rodzaju
Zdolności utleniające drobin są tym silniejsze, im wyższa jest wartość potencjału redoks (E) półogniwa, którego są one składową. Na przykład wartość standardowego potencjału redoks półogniwa Cl2 + 2e ⇄ 2Cl– jest wyższa, niż półogniwa Br2 + 2e ⇄ 2Br–. W konsekwencji cząsteczki chloru mogą utlenić jony bromkowe do wolnego bromu, a reakcja taka może być zapisana równaniem: Cl2 + 2Br– → 2Cl– + Br2.
W ogniwie zbudowanym z półogniw metalicznych Zn/Zn2+ oraz Fe/Fe2+ oba roztwory miały taką samą objętość równą 500 cm3, a stężenia molowe jonów metali wynosiły po 0,01 mol·dm–3. Podczas pracy tego ogniwa masa płytki cynkowej zmieniła się o 130 mg.
Oblicz, jakie było stężenie (mmol·dm–3) jonów żelaza(II) po zakończeniu eksperymentu? Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zależność szybkości reakcji chemicznej od pojemności reaktora
Biegnącą zgodnie z kinetyką pierwszego rzędu reakcję rozkładu tlenku azotu(V) przedstawia równanie stechiometryczne:
2N2O5(g) → 4NO(g) + 3O2(g)
Przeprowadzono rozkład 2 moli tlenku azotu(V) w dwóch reaktorach o różnej pojemności – 0,5 dm3 oraz 2 dm3.
Napisz równanie kinetyczne opisanego procesu i określ, w którym z reaktorów reakcja przebiegła z większą szybkością, w tej samej temperaturze? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
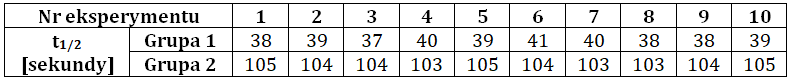
Obliczanie stężenia, przy jakim reakcja biegnie z taką samą szybkością, jak w innym roztworze
Szybkość reakcji chemicznych zależy od stężeń molowych reagujących ze sobą drobin (na przykład cząsteczek, jonów).
W dwóch zlewkach umieszczono roztwory kwasów o identycznej temperaturze i takiej samej objętości – w zlewce pierwszej 0,005-molowy kwas solny, natomiast w drugiej z nich 0,5-molowy kwas mrówkowy. Do każdej ze zlewek wrzucono taką samą ilość wiórek magnezowych i zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Jakie powinno być stężenie początkowe roztworu kwasu mrówkowego, aby w chwili rozpoczęcia reakcji jej szybkość była identyczna z szybkością reakcji z zastosowaniem 0,005-molowego roztworu kwasu solnego? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
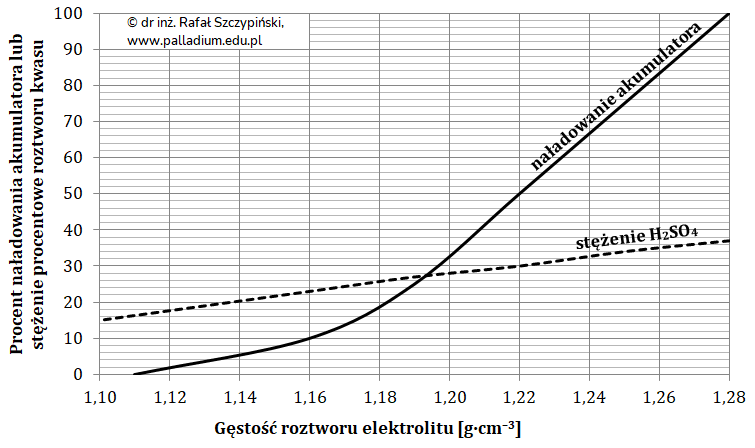
Obliczanie zmiany mas elektrod w akumulatorze kwasowo-ołowiowym po zakończeniu jego pracy (ogniwa)
Akumulator kwasowo-ołowiowy jest popularnym magazynem energii elektrycznej stosowanym w pojazdach spalinowych. Pojemność takiej baterii (zgromadzony w niej ładunek elektryczny) wyraża się w amperogodzinach (Ah). Na przykład, w temperaturze 25 oC akumulator o pojemności 50 Ah jest w stanie zasilać urządzenie elektryczne przez 50 godzin prądem o natężeniu 1 A. W tym czasie ulega on rozładowywaniu, co obrazują zachodzące na jego elektrodach reakcje chemiczne:
![]()
Na podstawie: www.intercars.pl
Pewien akumulator o pojemności 35 Ah został całkowicie rozładowany.
Oblicz, jak zmieniła się wówczas masa jego katody oraz anody. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis sumarycznego równania reakcji przebiegającej podczas ładowania akumulatora kwasowo-ołowiowego (ogniwa)
Akumulator kwasowo-ołowiowy jest popularnym magazynem energii elektrycznej stosowanym w pojazdach spalinowych. Pojemność takiej baterii (zgromadzony w niej ładunek elektryczny) wyraża się w amperogodzinach (Ah). Na przykład, w temperaturze 25 oC akumulator o pojemności 50 Ah jest w stanie zasilać urządzenie elektryczne przez 50 godzin prądem o natężeniu 1 A. W tym czasie ulega on rozładowywaniu, co obrazują zachodzące na jego elektrodach reakcje chemiczne:
![]()
Na podstawie: www.intercars.pl
Częściowo rozładowany akumulator można naładować. W trakcie tego procesu zmieniona zostaje polaryzacja elektrod, co w konsekwencji prowadzi do przebiegu reakcji odwrotnych.
Napisz w formie jonowej sumaryczne równanie procesu biegnącego podczas ładowania akumulatora kwasowo-ołowiowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone