Ocena poprawności zdań dotyczących przemian chemicznych przedstawionych schematem
Rysunek poniżej ilustruje schemat kilkunastu przemian chemicznych z udziałem oznaczonych literami A÷M związków organicznych. Substancje te są głównymi (uprzywilejowanymi) produktami opisanych przemian.
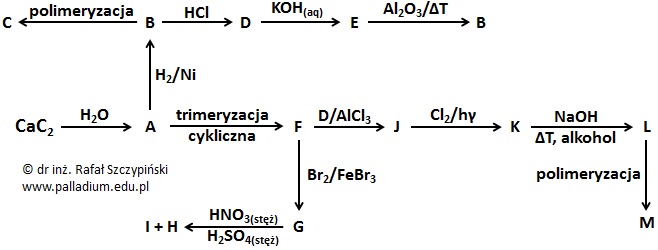
Oceń poprawność poniższych zdań dotyczących przemian przedstawionych schematem w informacji wprowadzającej. Wpisz literę „P” (prawda) lub literę „F” (fałsz). 1. Przemianie CaC2 ⟶ A przypisuje się ujemną wartość efektu cieplnego. 2. Podczas przemiany J ⟶ K światło pełni rolę katalizatora, natomiast w przemianie F ⟶ G katalizatorem jest wykorzystane żelazo. 3. Przemiana B ⟶ D przebiega według mechanizmu nukleofilowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie procentu wagowego jonów wapnia w mieszaninie poreakcyjnej uzyskanej w wyniku częściowego rozkładu węglanu wapnia. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
W otwartym naczyniu prowadzono termiczny rozkład 4 g węglanu wapnia. Po pewnym czasie reakcję przerwano, stwierdzając, że stopień przereagowania substratu wynosi 30%.
Oblicz zawartość jonów wapnia w poreakcyjnej mieszaninie substancji stałych. Wynik wyraź w procentach wagowych, stosując przybliżenie do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących analizy termograwimetrycznej próbki gipsu krystalicznego. Temat I - skład mieszaniny w reakcjach chemicznych
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do analizy stopnia uwodnienia hydratów. Na przykład gips krystaliczny CaSO4·2H2O ulega dwuetapowemu odwodnieniu. W pierwszym etapie następuje częściowe odwodnienie próbki, w efekcie dochodzi do utworzenia się hydratu o mniejszym stopniu uwodnienia i masie mniejszej o 15,7% względem wyjściowego substratu. W drugim etapie, podczas dalszego ogrzewania powstaje sól bezwodna.
Na podstawie: N. Okubo, Measuring crystal water in hydrates by thermogravimetry, Tokyo 1993.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Gdy próbka czystego gipsu krystalicznego poddanego badaniu termograwimetrycznemu utraci 5% masy, zawierać będzie w swym składzie co najmniej dwa hydraty. 2. Hydrat uzyskany w pierwszym etapie doświadczenia jest mniej trwały termicznie niż gips krystaliczny. 3. Procent wagowy jonów wapnia w próbce zmienia się w trakcie przebiegu doświadczenia, ale ich masa jest stała. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru hydratu powstałego jako produkt pośredni podczas badania termograwimetrycznego. Temat I - ustalanie wzoru hydratu
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do analizy stopnia uwodnienia hydratów. Na przykład gips krystaliczny CaSO4·2H2O ulega dwuetapowemu odwodnieniu. W pierwszym etapie następuje częściowe odwodnienie próbki, w efekcie dochodzi do utworzenia się hydratu o mniejszym stopniu uwodnienia i masie mniejszej o 15,7% względem wyjściowego substratu. W drugim etapie, podczas dalszego ogrzewania powstaje sól bezwodna.
Na podstawie: N. Okubo, Measuring crystal water in hydrates by thermogravimetry, Tokyo 1993.
Na podstawie niezbędnych obliczeń ustal wzór hydratu uzyskiwanego w pierwszym etapie analizy termograwimetrycznej próbki gipsu krystalicznego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie czystości próbki gipsu krystalicznego na podstawie analizy termograwimetrycznej. Temat I - skład mieszaniny w reakcjach chemicznych
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do analizy stopnia uwodnienia hydratów. Na przykład gips krystaliczny CaSO4·2H2O ulega dwuetapowemu odwodnieniu. W pierwszym etapie następuje częściowe odwodnienie próbki, w efekcie dochodzi do utworzenia się hydratu o mniejszym stopniu uwodnienia i masie mniejszej o 15,7% względem wyjściowego substratu. W drugim etapie, podczas dalszego ogrzewania powstaje sól bezwodna.
Na podstawie: N. Okubo, Measuring crystal water in hydrates by thermogravimetry, Tokyo 1993.
Badaniu termograwimetrycznemu poddano próbkę zanieczyszczonego gipsu krystalicznego o masie 2,24 g. Po zakończeniu doświadczenia stwierdzono, że masa stałej pozostałości wynosi 1,79 g.
Wiedząc, że zanieczyszczenia są trwałe termicznie w warunkach prowadzonego eksperymentu, określ na podstawie niezbędnych obliczeń czystość próbki gipsu krystalicznego jaka została poddana analizie termograwimetrycznej. Wynik wyraź w procentach wagowych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru sumarycznego soli na podstawie analizy termograwimetrycznej. Temat I - ustalanie wzoru empirycznego (elementarnego) oraz rzeczywistego
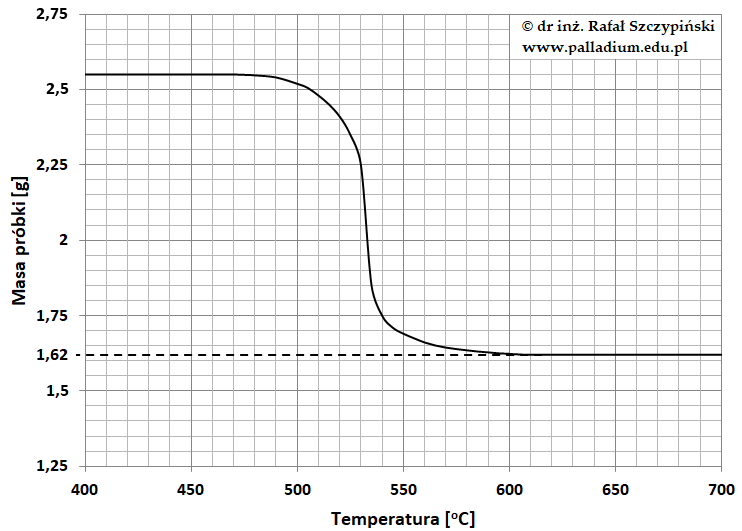
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do określania wzorów sumarycznych związków chemicznych. Podczas jednego z eksperymentów badaniu poddano próbkę pewnej soli, której krzywa termograwimetryczna ma następujący przebieg:
Na podstawie: W. Szczepaniak, Metody instrumentalne w analizie chemicznej, Warszawa 2012.
Ustalono ponadto, że w warunkach prowadzonego eksperymentu wydzieliła się czerwonobrunatna mieszanina dwóch gazów, która po przepuszczeniu przez płuczkę zawierającą wodny roztwór wodorotlenku potasu spowodowała przyrost jej masy o 690 mg, zaś podtrzymujący palenie gaz, jaki opuścił płuczkę zajął w warunkach normalnych objętość 168 cm3.
Wiedząc, że stałym produktem uzyskanym w wyniku przeprowadzonego eksperymentu było metaliczne srebro, ustal na podstawie niezbędnych obliczeń wzór sumaryczny soli poddanej analizie termograwimetrycznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego mieszaniny hydratów siarczanu(VI) miedzi(II) poddanej prażeniu. Temat I - skład mieszaniny w reakcjach chemicznych
Z pojemnika zawierającego 250 g mieszaniny dwóch hydratów: CuSO4 · 3H2O oraz CuSO4 · 5H2O odważono dwie próbki o masie 7,32 g każda. Pierwszą z nich umieszczono w tyglu porcelanowym, a drugą rozłożono równomiernie na ceramicznej płytce wykonanej z tego samego materiału, co tygiel. Obie próbki wprowadzono do pieca i poddano całkowitemu odwodnieniu w temperaturze 170 oC. Po zakończeniu doświadczenia stwierdzono, że masy uzyskanych w obu naczyniach białych substancji stałych stanowiły po 65,6% masy każdej z mieszanin poddanych prażeniu.
Oblicz procentowy skład wagowy mieszaniny hydratów poddanej odwodnieniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie w jakim stosunku molowym zmieszano propano-1-aminę z butano-1-aminą (miareczkowanie)
Próbkę o masie 2,57 g stanowiącą propano-1-aminę oraz butano-1-aminę wprowadzono do wody destylowanej i przeprowadzono miareczkowanie wykorzystując 90 cm3 roztworu kwasu bromowodorowego o stężeniu 0,5 mol∙dm–3. Nadmiar kwasu zobojętniono za pomocą 62,5 cm3 0,08-molowego roztworu wodorotlenku potasu.
Na podstawie niezbędnych obliczeń ustal, w jakim stosunku molowym pozostawały względem siebie aminy w próbce poddanej miareczkowaniu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie odczynu roztworu w punkcie równoważnikowym miareczkowania roztworu etanoaminy z uzasadnieniem
Miareczkowano wodny roztwór etanoaminy zawierający 150 mg tej substancji chemicznej. Jako titrant zastosowano 0,1-molowy roztwór kwasu solnego. Punkt równoważnikowy osiągnięto, gdy objętość zmiareczkowanego roztworu była równa 250 cm3.
Określ, jaki odczyn (kwasowy, zasadowy czy obojętny) miał roztwór uzyskany w punkcie równoważnikowym miareczkowania? Odpowiedź uzasadnij równaniem chemicznym przebiegającego procesu, zapisanym w formie jonowej skróconej. Odczyn roztworu w punkcie równoważnikowym: Uzasadnienie: Wskaż sprzężone (zgodnie z teorią Brønsteda) pary kwas-zasada (uzupełnij tabelę): © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone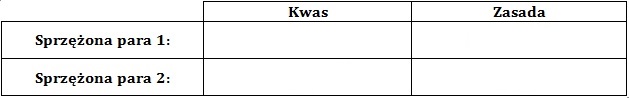
Obliczanie wartości pH roztworu etyloaminy poddanego miareczkowaniu (miareczkowanie)
Miareczkowano wodny roztwór etanoaminy zawierający 150 mg tej substancji chemicznej. Jako titrant zastosowano 0,1-molowy roztwór kwasu solnego. Punkt równoważnikowy osiągnięto, gdy objętość zmiareczkowanego roztworu była równa 250 cm3.
Pomijając zjawisko kontrakcji, oblicz wartość pH roztworu etanoaminy poddanego miareczkowaniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie przyczyny różnic w temperaturach wrzenia wybranych amin
Poniżej przedstawiono wzory cząsteczek czterech amin (A÷D) o prostych łańcuchach węglowych:
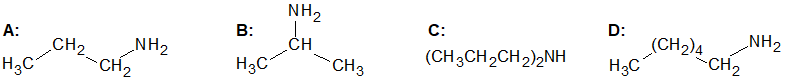
Pomiędzy oznaczeniami literowymi (A÷D) amin wpisz znak „>” lub „<”, opisujący relacje między wartościami ich temperatur wrzenia. Uzasadnij swoje stanowisko. A ………… B C ………… D © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przyczyny klasyfikacji dwóch związków organicznych do amin III-rzędowych
Aktywatorami sieciowania nienasyconych żywic poliestrowych mogą być III-rzędowe aminy aromatyczne – na przykład N,N-dimetyloanilina lub N,N-dimetylo-4-metyloanilina.
Na podstawie: G. Rokicki (red.), Ćwiczenia laboratoryjne z chemii związków wielkocząsteczkowych, Warszawa 2001.
Wyjaśnij, dlaczego wymienione związki chemiczne zalicza się do amin III-rzędowych? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów cząsteczek dwóch III-rzędowych amin aromatycznych
Aktywatorami sieciowania nienasyconych żywic poliestrowych mogą być III-rzędowe aminy aromatyczne – na przykład N,N-dimetyloanilina lub N,N-dimetylo-4-metyloanilina.
Na podstawie: G. Rokicki (red.), Ćwiczenia laboratoryjne z chemii związków wielkocząsteczkowych, Warszawa 2001.
Narysuj wzory półstrukturalne (grupowe) cząsteczek wymienionych w informacji wprowadzającej amin. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń w nawiasach dotyczących struktury cząsteczek dwóch III-rzędowych amin aromatycznych
Aktywatorami sieciowania nienasyconych żywic poliestrowych mogą być III-rzędowe aminy aromatyczne – na przykład N,N-dimetyloanilina lub N,N-dimetylo-4-metyloanilina.
Na podstawie: G. Rokicki (red.), Ćwiczenia laboratoryjne z chemii związków wielkocząsteczkowych, Warszawa 2001.
Przeanalizuj budowę cząsteczek amin opisanych w informacji wprowadzającej, a następnie podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Wymienione aminy są względem siebie (izomerami/homologami), co oznacza, że ich cząsteczki (różnią/nie różnią) się procentową zawartością azotu. W obu cząsteczkach liczba atomów węgla leżących na tej samej płaszczyźnie jest (taka sama/różna), ponadto mają (taką samą/różną) liczbę atomów węgla, których orbitalom walencyjnym przypisuje się model hybrydyzacji sp2. Orbitalom walencyjnym atomu azotu każdej z wymienionych amin przypisuje się hybrydyzację typu (sp/sp2/sp3). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

