Obliczanie rozpuszczalności hydratu chlorku żelaza(II) na podstawie stężenia procentowego nasyconego roztworu (rozpuszczalność substancji)
Nasycony w temperaturze 20 oC wodny roztwór chlorku żelaza(II) ma stężenie równe 38,5%.
Oblicz (wyrażoną w g/100 g wody) rozpuszczalność hydratu o wzorze sumarycznym FeCl2∙4H2O użytego do sporządzenia opisanego nasyconego roztworu chlorku żelaza(II). Wynik podaj z dokładnością do całkowitej liczby gramów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie przyczyny bardzo dobrej rozpuszczalności sorbitolu w wodzie
Sorbitol jest wielohydroksylowym, bardzo dobrze rozpuszczalnym w wodzie alkoholem. Zamieszczony rysunek przedstawia wzór cząsteczki tego związku chemicznego, narysowany w projekcji Fischera. Zmieniając pojedynczo konfigurację na przeciwną tylko dwóch jego centrów chiralności (w jednym z nich zmieniamy, a przy drugim wówczas już nie – i na odwrót), uzyskuje się dwa nieczynne optycznie izomeryczne alkohole A i B.
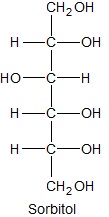
Wyjaśnij, dlaczego sorbitol jest związkiem chemicznym bardzo dobrze rozpuszczalnym w wodzie? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności siarczanu(VI) magnezu na podstawie rozpuszczalności jego hydratu (rozpuszczalność substancji)
W temperaturze 20 oC rozpuszczalność siarczanu(VI) magnezu-woda (1/7) ma wartość równą 105,5 g/100 g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozpuszczając w wodzie w danych warunkach określoną masę hydratu można uzyskać nasycony roztwór soli bezwodnej.
Oblicz rozpuszczalność bezwodnego siarczanu(VI) magnezu w temperaturze 20 oC. Wynik podaj w g/ 100 g wody, z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Szeregowanie roztworów wodnych ze wzrostem wartości pH
Dane są wodne roztwory o takim samym stężeniu molowym znajdujących się w nich związków chemicznych: etanoaminy, N-metyloacetamidu, wodorotlenku potasu i kwasu masłowego.
Uszereguj je zgodnie ze wzrastającą wartością pH. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie projekcji Fischera cząsteczek alkoholi, które nie wykazują czynności optycznej (izomeria optyczna)
Sorbitol jest wielohydroksylowym, bardzo dobrze rozpuszczalnym w wodzie alkoholem. Zamieszczony rysunek przedstawia wzór cząsteczki tego związku chemicznego, narysowany w projekcji Fischera. Zmieniając pojedynczo konfigurację na przeciwną tylko dwóch jego centrów chiralności (w jednym z nich zmieniamy, a przy drugim wówczas już nie – i na odwrót), uzyskuje się dwa nieczynne optycznie izomeryczne alkohole A i B.

Narysuj projekcje Fischera alkoholi A i B, a następnie wyjaśnij dlaczego związki te nie wykazują czynności optycznej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego nasyconego roztworu siarczanu(VI) magnezu na podstawie rozpuszczalności jego hydratu (rozpuszczalność substancji)
W temperaturze 20 oC rozpuszczalność siarczanu(VI) magnezu-woda (1/7) ma wartość równą 105,5 g/100 g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozpuszczając w wodzie w danych warunkach określoną masę hydratu można uzyskać nasycony roztwór soli bezwodnej.
Oblicz stężenie procentowe nasyconego w temperaturze 20 oC roztworu siarczanu(VI) magnezu. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazwy systematycznej sorbitolu oraz liczby asymetrycznych atomów węgla w cząsteczce (izomeria optyczna)
Sorbitol jest wielohydroksylowym, bardzo dobrze rozpuszczalnym w wodzie alkoholem. Zamieszczony rysunek przedstawia wzór cząsteczki tego związku chemicznego, narysowany w projekcji Fischera. Zmieniając pojedynczo konfigurację na przeciwną tylko dwóch jego centrów chiralności (w jednym z nich zmieniamy, a przy drugim wówczas już nie – i na odwrót), uzyskuje się dwa nieczynne optycznie izomeryczne alkohole A i B.

Podaj nazwę systematyczną sorbitolu, a następnie podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Nazwa systematyczna sorbitolu: …………………………………………………………….…………………… Alkohole A i B są względem siebie (enancjomerami/diastereoizomerami), a liczba asymetrycznych atomów węgla w ich cząsteczkach jest (różna/taka sama). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy hydratu oraz roztworu siarczanu(VI) magnezu w celu uzyskania nasyconego roztworu soli (rozpuszczalność substancji)
W temperaturze 20 oC rozpuszczalność siarczanu(VI) magnezu-woda (1/7) ma wartość równą 105,5 g/100 g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozpuszczając w wodzie w danych warunkach określoną masę hydratu można uzyskać nasycony roztwór soli bezwodnej.
Oblicz, jaką masę opisanego hydratu oraz 15% roztworu siarczanu(VI) magnezu należy zmieszać, aby w temperaturze 20 oC uzyskać 845 g nasyconego roztworu MgSO4? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy hydratu oraz wody destylowanej w celu uzyskania nasyconego roztworu soli siarczanu(VI) magnezu (rozpuszczalność substancji)
W temperaturze 20 oC rozpuszczalność siarczanu(VI) magnezu-woda (1/7) ma wartość równą 105,5 g/100 g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozpuszczając w wodzie w danych warunkach określoną masę hydratu można uzyskać nasycony roztwór soli bezwodnej.
Oblicz, jaką masę opisanego hydratu oraz wody destylowanej należy zmieszać, aby w temperaturze 20 oC uzyskać 244 g nasyconego roztworu MgSO4? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego jonów chlorkowych w roztworze powstałym z udziałem hydratu chlorku żelaza(III)
W temperaturze 20 oC rozpuszczalność sześciowodnego chlorku żelaza(III) ma wartość 395 g/ 100g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W zlewce z wodą destylowaną rozpuszczono taką ilość opisanego hydratu chlorku żelaza(III), że uzyskano 25 g nasyconego w temperaturze 20 oC roztworu soli bezwodnej. Następnie w kolbie miarowej o pojemności 50 cm3 umieszczono 10 g opisanego roztworu i uzupełniono wodą destylowaną „do kreski”, a do pozostałej w zlewce substancji dodano 100 cm3 wody destylowanej.
Oblicz stężenie molowe jonów chlorkowych w docelowym roztworze, jaki znajdował się w kolbie miarowej. Wynik podaj z dokładnością do trzech cyfr znaczących © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentu wagowego jonów żelaza(III) w roztworze uzyskanym z wykorzystaniem hydratu chlorku żelaza(III)
W temperaturze 20 oC rozpuszczalność sześciowodnego chlorku żelaza(III) ma wartość 395 g/ 100g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W zlewce z wodą destylowaną rozpuszczono taką ilość opisanego hydratu chlorku żelaza(III), że uzyskano 25 g nasyconego w temperaturze 20 oC roztworu soli bezwodnej. Następnie w kolbie miarowej o pojemności 50 cm3 umieszczono 10 g opisanego roztworu i uzupełniono wodą destylowaną „do kreski”, a do pozostałej w zlewce substancji dodano 100 cm3 wody destylowanej.
Oblicz, jaki procent masy znajdującego się w zlewce docelowego roztworu stanowiły jony żelaza(III)? Wynik podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy pozostałego roztworu po odparowaniu wody oraz wykrystalizowaniu hydratu
Hydrat o wzorze CuSO4·5H2O w temperaturze 40 oC ma rozpuszczalność 53,2 g/100 g wody. Przygotowano 200 g nasyconego w 40 oC roztworu soli bezwodnej. Po pewnym czasie stwierdzono, że w opisanych warunkach temperaturowych masa zawartości naczynia zmalała o 10 g, a na jego dnie pojawiły się kryształki opisanego hydratu, które odsączono.
Oblicz masę roztworu pozostałego po odsączeniu wykrystalizowanego hydratu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone